
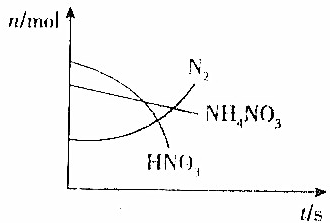
 某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )
某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )| A. | N2是还原产物,Zn(NO3)2是氧化产物 | |
| B. | NH4NO3是氧化剂,Zn是还原剂 | |
| C. | 反应生成1molN2时共有5mol电子转移 | |
| D. | HNO3在反应中没有表现出酸性 |
分析 由图可知HNO3、NH4NO3的物质的量减少是反应物,所以反应方程式为:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O中,Zn元素的化合价由0升高为+2价,N元素的化合价既升高又降低,以此来解答.
解答 解:由图可知HNO3、NH4NO3的物质的量减少是反应物,所以反应方程式为:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O中,Zn元素的化合价由0升高为+2价,N元素的化合价既升高又降低,
A.N2是还原产物也是氧化产物,Zn(NO3)2只是氧化产物,故A错误;
B.NH4NO3是还原剂,Zn是还原剂,故B错误;
C.由硝酸中N元素的化合价变化可知,反应中生成1 molN2时共有5mol电子发生转移,故C正确;
D.HNO3在反应中生成硝酸锌,表现出酸性,故D错误;
故选C.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,侧重氧化还原反应中的基本概念、转移电子数的考查,题目难度不大.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:实验题
 ,能证明凯库勒观点错误的实验现象是C中产生“喷泉”现象.
,能证明凯库勒观点错误的实验现象是C中产生“喷泉”现象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,44gCO2含有NA个C原子 | |
| B. | 1 L0.1mol•L-1Na2S溶液中含有0.1NA个S2- | |
| C. | 0.1mol Na与足量O2反应,转移0.2NA个电子 | |
| D. | 标准状况下,22.4L的CCl4含有4NA个Cl原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成份是氯酸钙 | B. | 氟化氢溶于水形成的氢氟酸是强酸 | ||
| C. | 碘化钾水溶液能使淀粉变蓝 | D. | 氟气通入水中有氧气生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com