
【题目】在某温度下,冰醋酸(纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:
(1)起点导电能力为0的理由是__________________.
(2)用湿润的pH试纸测量a处溶液的pH,测量结果______(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)

①pH:________;
②醋酸的电离程度:_________;
③醋酸的电离平衡常数:____________;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:______.
(4)若使c点溶液中c(CH3COO﹣)增大,c(H+)减小,可采用的措施有(答二类不同的物质):①_________,②__________.
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是______.
A.c(H+) B.H+个数 C.CH3COOH个数 D.![]()
【答案】无自由移动的离子 偏小c>a>bc>b>aa=b=ca=b=c加 NaOH 加 Na2CO3、锌等BD
【解析】
(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)用湿润的pH试纸测量a处溶液的pH,相对于将溶液稀释;
(3)①导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
②溶液越稀,越促进醋酸电离;
③弱电解质的电离平衡常数只受温度影响,温度不变,电离平衡常数不变;
④abc三点醋酸浓度不同,但所含醋酸的物质的量相同;
(4)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可溶性盐、加入固体碱或加入和氢离子反应的固体物质;使c(H+)减小,可以加碱或加入和氢离子反应的固体物质;
(5)加水稀释,促进电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此解答。
(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,因此,本题正确答案是:无自由移动的离子。
(2)据图可以知道将a处醋酸稀释,氢离子浓度增大,所以用湿润的pH试纸测量a处溶液的pH,测量结果偏小,因此,本题正确答案是:偏小。
(3)①导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为c>a>b,因此,本题正确答案是:c>a>b。
②溶液越稀,越促进醋酸电离,醋酸的电离度由大到小的顺序为c>b>a,因此,本题正确答案是:c>b>a。
③弱电解质的电离平衡常数只受温度影响,温度不变,电离平衡常数不变,所以abc三点的电离平衡常数相等,因此,本题正确答案是:a=b=c。
④abc三点醋酸浓度不同,但所含醋酸的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积相同,因此,本题正确答案是:a=b=c。
(4)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可溶性盐、加入固体碱或加入和氢离子反应的固体物质;使c(H+)减小,可以加碱或加入和氢离子反应的固体物质,综合考虑,可以加入NaOH、 Na2CO3、锌等;因此,本题正确答案是:加NaOH;加 Na2CO3、锌等。
(5)A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;
B.弱电解质越稀,电离度越大,即电离出的氢离子数越多,故B正确;
C.弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,故C错误;
D.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,在同一溶液中,体积相同,则![]() =n(H+)/n(CH3COOH),比值增大,故D正确;
=n(H+)/n(CH3COOH),比值增大,故D正确;
因此,本题正确答案是:BD。


科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)图中X是________;Ⅰ在小麦种子中主要是指__________。
(2)在病毒中,携带遗传信息的物质是________________(填序号)。
(3)图中A、B分别代表何种元素?A:______,B:______。
(4)导致地球上生物多种多样的直接原因是[ ] _________(填序号和名称)结构的多样性。
(5)物质Ⅱ在人体细胞中的主要载体是________,该分子中______________决定了物质Ⅱ的多样性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. 先a通入CO2,然后b通入NH3,c中放碱石灰
B. 先b通入NH3,然后a通入CO2,c中放碱石灰
C. 先a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. 先b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是

A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硝通常指将烟气中的氮氧化物(NOx)转化为无害的物质。
(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-905.5kJ·mol-1
4NO(g)+6H2O(g) △H=-905.5kJ·mol-1
N2(g)+O2(g) ![]() 2NO(g) △H=+l80kJ mol-1
2NO(g) △H=+l80kJ mol-1
完成该方法中主要反应的热化学方程式:
4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) △H=___________。
4N2(g)+6H2O(g) △H=___________。
该方法应控制反应温度在315400℃之间,反应温度不宜过低也不宜过高的原因是___________。
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如下图所示,则X是______ (填学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向____方向移动。当[n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。

(2)直接电解吸收也是脱硝的一种方法,用6%的稀硝酸吸收NOx生成HNO2(—元弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如上右图所示。①图中b应连接电源的______(填“正极”或“负极”)。②a电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量且足量的两份锌a、b,分别加入等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列各图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
A. 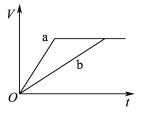 B.
B. 
C. 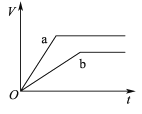 D.
D. 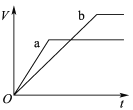
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是
A. K+、HCO3-、CO32-、Br﹣ B. CO32-、HCO3-、OH﹣、K+
C. K+、Ca2+、NO3-、CO32- D. H+、Cl﹣、Na+、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是七个基本____________之一,用来表示____________________的集合,符号是___________,单位符号是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
(1)该反应的逆反应是________热反应,且m+n______(填“>”“<”或“=”)p。
(2)若加入B(体积不变),则A的转化率_______,B的转化率_____。(填“增大”“减小”或“不变”,下同)。
(3)若加入催化剂,平衡时气体混合物的总物质的量________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若B是有色物质,A.C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com