
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、用萃取分液的方法除去酒精中的水 |
| C、用可见光束照射以区别溶液和胶体 |
| D、根据火焰所呈现的特征焰色,只能检验金属离子的存在 |


科目:高中化学 来源: 题型:
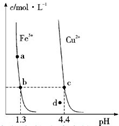 某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )
某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )| A、Ksp〔Fe (OH)3〕<Ksp〔Cu (OH)2〕 |
| B、加适量NH4Cl固体可使溶液由a 点变到b点 |
| C、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| D、Fe (OH)3、Cu (OH)2分别在b、c两点代表的溶液中达到饱和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
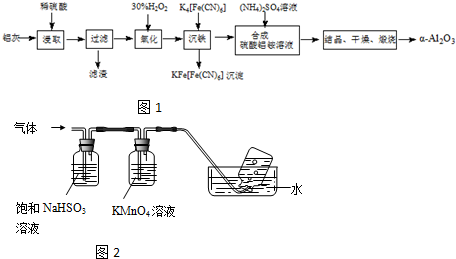
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
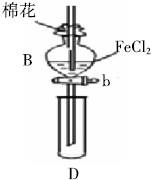 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用标准的NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液---浅红色 |
| B、用标准FeCl3溶液滴定KI溶液以测定其浓度:淀粉溶液---蓝色 |
| C、用标准酸性KmnO4溶液滴定Na2SO3溶液以测定其浓度:KmnO4溶液---紫红色 |
| D、利用“Ag++SCN═AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液---红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
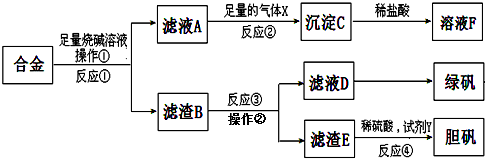
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
| B、通入SO2气体后的溶液:Na+、Ca2+、K+、Cl- |
| C、0.1 mol?L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| D、1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
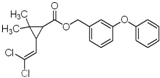
| A、分子式为C21H20Cl2O3 |
| B、不能使溴水褪色 |
| C、1mol氯菊酯与氢气加成最多消耗8 mol H2 |
| D、与NaOH溶液反应最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol |
| B、0.04mol |
| C、0.06mol |
| D、0.08mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com