
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1molDAx与足量的A2C反应生成44.8L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T![]() W(未配平),测得各物质的浓度如表所示。
W(未配平),测得各物质的浓度如表所示。
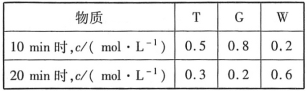
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,则该化合物的化学式为___。
(2)B、C、D、E的简单离子中,离子半径大小排序为___。(用具体的离子表示)
(3)J、L是由A、B、C、E四种元素组成的两种化合物,J、L溶液混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式:___;J、L中能使酸性高锰酸钾溶液褪色的是___(填化学式)。
(4)B2A4—C2碱性燃料电池放电效率高。该电池放电时,负极反应式为___;正极附近溶液的pH___(填“增大”“减小”或“不变”)。
(5)由上述五种元素中的四种组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示:
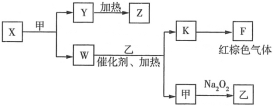
①Y是___(填化学式);W的电子式为___。
②B的最高价氧化物对应的水化物为Q,X与足量的Q溶液反应的化学方程式为___。
③1molW与足量乙完全反应生成K和甲,转移的电子数约为___。
【答案】NH4NO3(或NH4NO2) r(S2-)>r(N3-)>r(O2-)>r(Mg2+) HSO![]() +H+=SO2↑+H2O NH4HSO3 N2H4+4OH--4e-=N2↑+4H2O 增大 Mg(OH)2
+H+=SO2↑+H2O NH4HSO3 N2H4+4OH--4e-=N2↑+4H2O 增大 Mg(OH)2 ![]() Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3 3.01×1024
Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3 3.01×1024
【解析】
C原子最外层电子数是电子层数的3倍,即C为O,C和E位于同主族,即E为S,A、B、C的单质在常温下都呈气态,且原子序数依次增大,即A为H,B为N,A的单质为G,即G是H2,B的单质为T,即T为N2,化学反应中,各物质的化学反应速率之比等于化学计量数之比,再结合题给表格数据,得3G+T=2W,即W为NH3,1molDAx与H2O反应生成44.8LH2气体,氢气的物质的量为![]() =2mol,DHx中H显-1价,失电子,则x=2,D显+2价,其五种元素的原子序数依次增大,则D为Mg;以此解答。
=2mol,DHx中H显-1价,失电子,则x=2,D显+2价,其五种元素的原子序数依次增大,则D为Mg;以此解答。
(1)由分析可知,A为H,B为N,C为O;H、N、O三种元素组成既含有离子键又含共价键的化合物,该化合物为离子化合物,即该化合物为铵盐,化合物有NH4NO3、NH4NO2;故答案为:NH4NO3(或NH4NO2);
(2)由分析可知,B为N,C为O,D为Mg,D为Mg;四种元素的简单离子是N3-、O2-、Mg2+、S2-。S2-有3个电子层,半径最大;N3-、O2-、Mg2+三种离子的核外电子排布相同,核电荷数越大,半径越小;离子半径大小顺序是r(S2-)>r(N3-)>r(O2-)>r(Mg2+);
(3)四种元素组成化合物为酸式盐,即铵盐,该铵盐化学式为NH4HSO4、NH4HSO3,两种溶液发生的离子方程式为HSO3-+H+=SO2↑+H2O;NH4HSO3中S的化合价为+4价,以还原性为主,能使酸性高锰酸钾溶液褪色;
(4)B2A4为N2H4,C2为O2,N2H4与O2反应方程式为N2H4+O2=N2+2H2O,负极反应式为N2H4+4OH--4e-=N2↑+4H2O;正极反应式为O2+2H2O+4e-=4OH-,正极附近产生氢氧根,pH增大;
(5)F为红棕色气体,即F为NO2,K为NO,联系氨的催化氧化反应,W为NH3,乙为O2,甲为H2O,M为耐高温的物质,M可能为Al2O3,也可能为MgO,根据转化关系,X为Mg3N2,Y为Mg(OH)2,Z为MgO;NH3的电子式为:![]() ;
;
②氮化镁与足量的HNO3溶液反应生成硝酸镁和硝酸铵,化学方程式为:Mg3N2+8HNO3
③NH3的催化氧化发生的反应方程式为4NH3+5O2![]() 4NO+6H2O,氮元素由-3价上升到+2价,1mol NH3完全反应转移5mol电子,转移的电子数约为:5mol
4NO+6H2O,氮元素由-3价上升到+2价,1mol NH3完全反应转移5mol电子,转移的电子数约为:5mol ![]() 6.02
6.02 ![]() 1023=3.01
1023=3.01 ![]() 1024。
1024。


科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物X和Y都是从樟脑科植物中提取的香料。X可按下列路线合成Y。
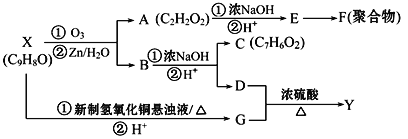
已知:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO
2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
(1)X的官能团名称为________;
(2)Y的结构简式为________;
(3)写出下列反应方程式:
X→G的第①步反应___________________;
E→F___________________;
(4) G的一种同分异构体H的结构简式为![]() ,写出以
,写出以![]() 为有机原料,制取H的合成路线(仿照下面路线,写清相应反应条件,无机物自选)。
为有机原料,制取H的合成路线(仿照下面路线,写清相应反应条件,无机物自选)。
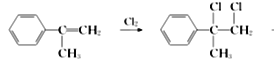 →____________________。
→____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B. 碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
C. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
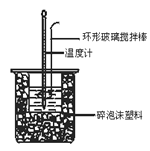
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.1mol物质均约含有6.02×1023个分子B.6.02×1023个氢分子就是1mol H2
C.1gH2与1mol H2所含分子数相等D.1mol H2O与1molH2SO4的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中化学知识复习:
(1)按要求填空
HCOOH中C的化合价_________;K2MnO4中Mn的化合价________;
FeCl2的名称是_________;原子序数为18的元素的符号是________;
(2)按要求各写出一个化学方程式:
化合反应:_____________;分解反应:_____________;
置换反应:_____________;复分解反应:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
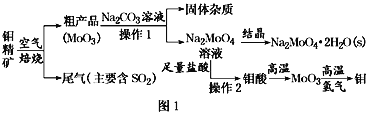
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
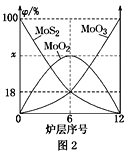
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种前四周期元素,原子序数依次增大。A为自然界中形成化合物种类最多的元素;C为地壳中含量最多的元素;D与A为同主族元素,且原子的质子数相差8;E是日常生活中用途最广、用量最大的金属元素。请回答下列问题:
(1)A的一种同位素具有放射性,在考古学上常用来测定文物的历史年代,写出该核素的符号:___。
(2)B的简单气态氢化物的电子式为___,若用玻璃棒蘸取浓盐酸靠近盛满该气体的集气瓶瓶口,则观察到的现象为___。
(3)C元素有16C、17C、18C三种核素,这三种核素的质子数之和为__。
(4)D元素在元素周期表中的位置为__,写出工业上制备含少量杂质的D单质的化学方程式: ___。
(5)写出少量E的单质与B的最高价氧化物对应的水化物的稀溶液反应的离子方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com