
����Ŀ���������ڹ�ҵ��������������Ҫ�����á���(Mo)�ij������ϼ�Ϊ+6��+5��+4�����⾫��(��Ҫ�ɷ���MoS2)���Ʊ�������������ƾ���(Na2MoO4��2H2O)������������ͼ1��ʾ��
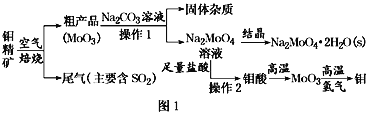
��֪����������ˮ��������Һ��Ͱ�ˮ��
�ش��������⣺
��1�������⾫��ʱ�����Ļ�ѧ����ʽΪ_____________________________��
��2���⾫����ʱ�ŷŵ�β���Ի�������ҪΣ����___________________�������һ��ʵ���ҳ�ȥ��β���ķ���____________________________________��
��3������2������Ϊ________��������õ�MoO3���õ��Ĺ����β���������������________��
��4�������⾫�����õ�װ���Ƕ�㱺��¯��ͼ2Ϊ��¯��������ϵ����ʵ����İٷ���(��)��
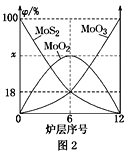
��x��________��
������¯��Ҳ�ᷢ��MoS2��MoO3��Ӧ����MoO2��SO2�ķ�Ӧ�����÷�Ӧת��6mol���ӣ������ĵ��������Ļ�ѧʽ�����ʵ����ֱ�Ϊ________��________��
��5������1�У�����̼������Һ��ַ�Ӧ���Һ��c(MoO42-)��0.80mol��L1��c(SO42-)��0.04 mol��L1���ڽᾧǰ�����Ba(OH)2�����Գ�ȥ��Һ�е�SO42-����BaMoO4��ʼ����ʱ��SO42-��ȥ������________��[Ksp(BaSO4)��1.1��1010��Ksp(BaMoO4)��4.0��108����Һ����仯�ɺ��Բ���]
���𰸡�2MoS2 + 7O2![]() 2MoO3 + 4SO2 �γ����� ���ð�ˮ������������Һ����(���������𰸾���) ���� ���� 64 MoO3 3mol 94.5%
2MoO3 + 4SO2 �γ����� ���ð�ˮ������������Һ����(���������𰸾���) ���� ���� 64 MoO3 3mol 94.5%
��������
�⾫��(��Ҫ�ɷ���MoS2)�������⾫��Ӧ�Ļ�ѧ����ʽΪ2MoS2+7O2 ![]() 2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2������Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO4��2H2O��Na2MoO4���������ᷴӦ�������ᣬ��������ˮ�����˵õ����ᣬ����������������MoO3�������£���������ԭMoO3�õ�Mo���ݴ˷������
2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2������Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO4��2H2O��Na2MoO4���������ᷴӦ�������ᣬ��������ˮ�����˵õ����ᣬ����������������MoO3�������£���������ԭMoO3�õ�Mo���ݴ˷������
(1)�⾫��(��Ҫ�ɷ���MoS2)������ʱ��MoS2����������Ӧ����MoO3ͬʱ���ɶ�������2MoS2+7O2 ![]() 2MoO3+4SO2���ʴ�Ϊ��2MoS2+7O2
2MoO3+4SO2���ʴ�Ϊ��2MoS2+7O2 ![]() 2MoO3+4SO2��
2MoO3+4SO2��
(2)�⾫����ʱ�ŷŵ�β���к��ж��������γ����ꣻ��������Ϊ������������ð�ˮ������������Һ���գ��ʴ�Ϊ���γ����ꣻ���ð�ˮ������������Һ���գ�
(3)��������ͼ������2�Ǵ�Na2MoO4�����ᷴӦ�����Һ�еõ����ᣬ��������ˮ���ù��˷���õ�����������·ֽ�õ�MoO3��Ҫ�������н��У��ʴ�Ϊ�����ˣ�������
(4)����ͼ2��֪���ڵ�6¯���д��ڵĹ������ʷֱ�ΪMoS2��MoO3��MoO2������MoS2��MoO3�����ʵ����ٷֱȾ�Ϊ18%������MoԪ���غ㣬��MoO2 �����ʵ����ٷֱ�Ϊ1-18%-18%=64%����xΪ64���ʴ�Ϊ��64��
��MoS2��MoO3��Ӧ����MoO2��SO2�ķ�ӦΪ��MoS2+6MoO3 ![]() 7MoO2+2SO2������MoS2��MoԪ�ػ��ϼ۲��䣬SԪ����-2���ߵ�+4�ۣ�������������ԭ����MoO3��MoԪ�ػ��ϼ���+6�۽��͵�+4�ۣ�����ԭ������������6mol������MoO3��Ӧת�Ƶ���12mol�����÷�Ӧת��6mol���ӣ������ĵ�MoO33mol���ʴ�Ϊ��MoO3��3mol��
7MoO2+2SO2������MoS2��MoԪ�ػ��ϼ۲��䣬SԪ����-2���ߵ�+4�ۣ�������������ԭ����MoO3��MoԪ�ػ��ϼ���+6�۽��͵�+4�ۣ�����ԭ������������6mol������MoO3��Ӧת�Ƶ���12mol�����÷�Ӧת��6mol���ӣ������ĵ�MoO33mol���ʴ�Ϊ��MoO3��3mol��
(5)c(MoO42-)=0.80molL-1��c(SO42-)=0.04molL-1����BaMoO4��ʼ����ʱ��c(Ba2+)=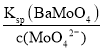 =
=![]() molL-1=5.0��10-8molL-1����ʱc(SO42-)=
molL-1=5.0��10-8molL-1����ʱc(SO42-)=![]() molL-1=2.2��10-3molL-1��SO42-��ȥ����=
molL-1=2.2��10-3molL-1��SO42-��ȥ����=![]() ��100%=94.5%���ʴ�Ϊ��94.5%��
��100%=94.5%���ʴ�Ϊ��94.5%��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ�������ֵΪNA������˵����ȷ���ǣ� ��
A.1mol����ϩ�к��е�![]() ����Ϊ4NA
����Ϊ4NA
B.2.8g��ϩ�ͱ�ϩ�Ļ������������̼ԭ����Ϊ0.2NA
C.0.1molCnH2n��2�к��е�C��C����Ϊ0.1nNA
D.��״���£�2.24LCCl4�к��еķ�����Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��A��B��C��D��E��ԭ��������������A��B��C�ĵ����ڳ����¶�����̬��Cԭ�������������ǵ��Ӳ�����3����C��Eλ��ͬ���塣1molDAx��������A2C��Ӧ����44.8L(��״��)G���塣A��B�ĵ�������ΪG��T�����ܱ������г���һ������G��T��һ�������·�����ӦG��T![]() W(δ��ƽ)����ø����ʵ�Ũ�������ʾ��
W(δ��ƽ)����ø����ʵ�Ũ�������ʾ��
�ش��������⣺
(1)A��B��C����ɼȺ����Ӽ��ֺ����ۼ��Ļ������û�����Ļ�ѧʽΪ___��
(2)B��C��D��E�ļ������У����Ӱ뾶��С����Ϊ___��(�þ�������ӱ�ʾ)
(3)J��L����A��B��C��E����Ԫ����ɵ����ֻ����J��L��Һ��Ͽɲ����д̼�����ζ�����壬д����������Һ������Ӧ�����ӷ���ʽ��___��J��L����ʹ���Ը��������Һ��ɫ����___(�ѧʽ)��
(4)B2A4��C2����ȼ�ϵ�طŵ�Ч�ʸߡ��õ�طŵ�ʱ��������ӦʽΪ___������������Һ��pH___(��������������С������������)��
(5)����������Ԫ���е�������ɵĵ��ʡ���������һ�������µ�ת����ϵ(���������Ͳ�����ʡ��)��ͼ��ʾ��
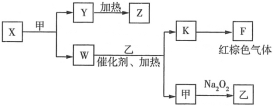
��Y��___(�ѧʽ)��W�ĵ���ʽΪ___��
��B������������Ӧ��ˮ����ΪQ��X��������Q��Һ��Ӧ�Ļ�ѧ����ʽΪ___��
��1molW����������ȫ��Ӧ����K�ͼף�ת�Ƶĵ�����ԼΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2��O3����Ԫ�ص����ֵ��ʣ����������ʽ������и��⣺
(1)���µ�ѹ�£���������O2��O3�������Ӹ�����Ϊ________��ԭ�Ӹ�����Ϊ________�����֮��Ϊ________��
(2)��NAΪ�����ӵ���������ֵ�����a g�����к��еķ�����Ϊb����c g�����ڱ�״���µ����Լ��________(�ú�NA��ʽ�ӱ�ʾ)��
(3)����500 mL 1 mol/L��ϡH2SO4��Һ����Ҫ����Ͳ��ȡŨH2SO4(�ܶ�Ϊ1.84 g/mL����������Ϊ98%)�����Ϊ________ mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���ں�CH3COOH��CH3COO-����Һ�У� CH3COOH��CH3COO-�����и�����ռ�����ʵ�������(a)����ҺpH�仯�Ĺ�ϵ��ͼ��ʾ��

����˵������ȷ����
A. ��pH<4.76����Һ�У�c(CH3COO-)<c(CH3COOH)
B. ��pH=7����Һ�У�a(CH3COOH)=0��a(CH3COO-)=1.0
C. ��pH>4.76����Һ�У�c(CH3COO-)��c(OH-)֮�Ϳɴ���c(H+)
D. ��pH=4.76����Һ�м����ᣬa(CH3COOH)��a(CH3COO-)֮�ͱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������˹�ģ�������úϳɼ����ԭ��Ϊ2CO2��2H2O=2HCOOH��O2��װ����ͼ��ʾ������˵������ȷ���ǣ� ��
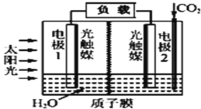
A.��װ���ܽ�̫����ת��Ϊ��ѧ�ܺ͵���
B.�����ɵ缫1������������缫2
C.�缫2�ķ�Ӧʽ��CO2��2H+��2e-=HCOOH
D.�缫1��ΧpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��CO��Fe+��ϵ�д�����ͼ�ס�����ʾ������ת���������ϵ��

����˵��������ǣ� ��
A.��ͼ��֪����Ӧ�����д�����H=��H1+��H2+��H3
B.Fe+�ڷ�Ӧ�����������ܽ��ͷ�Ӧ�Ļ��
C.����֪��H����H3��С��0�����֪��H1����H2Ҳ��С��0
D.��ͼ�ҿ�֪����ӦFe+(s)+N2O(g)=FeO+(s)+N2(g)����H4<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�鰴����ʵ�����֤���˺����д��ڵĵ�Ԫ�أ�
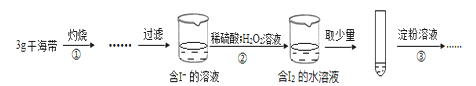
����˵������ȷ����
A.�������Ҫ���ɺ�����������������
B.����ڷ�Ӧ�����ӷ���ʽΪ��2I- +2H++H2O2=I2+2H2O
C.����۲����۲쵽�Թ�����Һ��Ϊ��ɫ������˵�������к��е�Ԫ��
D.������ڽ��μ�ϡ��������һ���������۲������Թ�����Һ�������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)��һ�����͡���Ч�������ɫˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
(1)�ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ��2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2�����÷�Ӧ�л�ԭ����___________________(�ѧʽ)����2 mol FeSO4��ԭ�Ĺ�������Ϊ_________mol
(2)ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ������������Fe(OH)3��ClO����OH����FeO42-��Cl����H2O��д�������������Ƹ�����ص����ӷ�Ӧ����ʽ��__________________________
����֪��2Fe3����2I��=2Fe2����I2��2Fe2����Br2=2Fe3����2Br����
(1)����1 mol FeI2��2 mol FeBr2����Һ��ͨ��2 mol Cl2����ʱ��������������____________�������������ӵ����ʵ����ֱ���_____________________________________________
(2)����a mol FeI2��b mol FeBr2����Һ��ͨ��c mol Cl2����I����Fe2��������ʱ��cΪ_____________(�ú�a��b�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com