
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:Na2SO4+ 4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013届江西省上饶市横峰中学高三第一次月考化学试卷(带解析) 题型:实验题
(本题共10分) 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜:如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。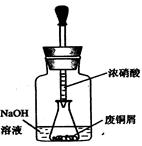
步骤二:碱式碳酸铜的制备:向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
①.上图装置中NaOH溶液的作用是_ _。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有__ __(填写化学式)。
②步骤二中,水浴加热所需仪器有__ __、_ _(加热、夹持仪器、石棉网除外);
洗涤的目的是__ __。
③.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
④.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是__ __。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省上饶市高三第一次月考化学试卷(解析版) 题型:填空题
(本题共10分)有机物M(C15H16O8)在酸性溶液中水解得A、B、C三种物质,A在170 ℃与浓硫酸混合加热,可得到一种具有催熟果实作用的气体D,A在一定条件也可以氧化成C。请回答下列问题:
(1) 300多年前,著名化学家波义耳发现了铁盐与B的显色反应,并由此发明了蓝黑墨水。用B制造墨水主要利用了 类化合物的性质。(填代号)
A.醇 B.酚? C.酯 D.羧酸
(2) M与NaOH反应的方程式是 。 ?
(3) B与丙醇反应得到的酯具有抗氧化作用,是目前广泛应用的食品添加剂.其结构简式为 ;C的同分异构体有(包括C) 种。
(4)写出由A生成D的化学反应方程式:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:计算题
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下: Na2SO4+
4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol, 则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一5月月考化学试卷(解析版) 题型:填空题
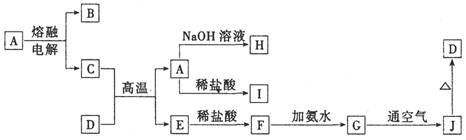
(本题共10分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:
(1)A物质的名称为________。
(2)C与D在高温下的反应在冶金工业上称为 反应,化学方程式为________ ,引发该反应的实验操作是________________________ 。
(3)G→J的化学方程式为_________________________________。
(4)A→H的离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com