
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下: Na2SO4+
4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol, 则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
(1)15.78 (2)2 mol ~ 4 mol (3)y =
(4)n(Na2SO3)=0.10 mol 、 n(Na2SO4)=0.05 mol
【解析】(1)根据硫原子守恒可知,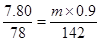 ,解得m=15.78g。
,解得m=15.78g。
(2)由反应①和②可得反应③:Na2SO4+ 2C Na2S + 2CO2↑
Na2S + 2CO2↑
根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:2 mol ~ 4 mol。(2分)
(3)根据反应①:
Na2SO4+ 4C Na2S + 4CO
Na2S + 4CO
ax mol ax/4 mol ax mol
根据反应③:
Na2SO4+ 2C  Na2S + 2CO2
Na2S + 2CO2
a mol a/2 mol a mol
根据题意得: a mol + ax mol =1 mol
a/2mol + ax/4 mol = y mol
解得:y =(2分)
(4)2Na2S+ Na2SO3+3 H2SO4=3 Na2SO4+ 3S↓+3H2O
Na2S+ H2SO4= Na2SO4+H2S
根据以上两个反应结合题中条件可求得: 39.20 g样品中有
Na2SO3: 0.10 mol Na2S: 0.250mol
再应用质量守恒得:Na2SO4:0.05 mol
39.20 g样品中氧化产物:n(Na2SO3)=0.10 mol (2分) n(Na2SO4)=0.05 mol(2分)


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2012届三校上海市(复旦、交大、华师大二附中)高三联考化学试卷(带解析) 题型:计算题
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:Na2SO4+ 4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市第二中学高二第一次月考化学试卷(带解析) 题型:计算题
(本题共10分)白磷、红磷是磷的两种同素异构体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足是生成P4O10。
(1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=" -2983.2" kJ?mol-1,
P(s,红磷)+ 5/4O2(g)="1/4" P4O10(s) ΔH2=" -738.5" kJ?mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s) ΔH= -1638kJ?mol-1。在某密闭容器中加入62g白磷和50.4L氧气(标准状况下),控制条件使之恰好完全反应。则所得到的P4O10和P4O6的物质的量之比为 ,反应过程中放出的热量为为 。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243,P-Cl 331。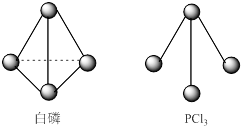
则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH = 。
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修5 1.1有机化合物的结构与性质 烃练习卷(解析版) 题型:实验题
实验题(本题共10分)
(1)现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和水 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
(2)某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
(A)把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞;(B)把盛有溶液的分液漏斗放在铁架台的铁圈中;(C)倒置漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;(D)检验分液漏斗活塞和上口的玻璃塞是否漏液;(E)旋开活塞,用烧怀接收溶液;(G)静置,分层(F)将分液漏斗上口倒出上层水溶液;(H)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;就此实验。完成下列填空:
①正确操作步骤的顺序是:(用上述各操的编号字母填写)
___→___→___→ → →____→ →
②上述(E)步骤的操作中应注意 ;上述(H)步骤操作的目的是 。
③能选用CCl4从碘水中萃取碘的原因是 。
④下列物质,不能作为从溴水中萃取溴的溶剂的是 。
A.热裂汽油 B.苯 C.酒精 D.正庚烷
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省天水市高一下学期检测化学试卷 题型:填空题
(本题共10分) A、B、C、D 四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。则元素:A为 B为 C为 ,D的质子数和中子数相等,D 的原子符号为: ,它的最高价氧化物对应的水化物: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com