
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
【答案】a<d<c<b B D ClO-+H2O+CO2=HCO3-+HClO 9.9×10﹣7molL﹣1 ![]() c(HCO3﹣)+c(H+)
c(HCO3﹣)+c(H+)
【解析】
(1)弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
(2)0.1molL﹣1的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,醋酸分子物质的量减小,浓成小,酸性减弱,水的离子积常数不变,醋酸的电离平衡常数不变;
(3)次氯酸酸性大于碳酸氢根离子,反应生成碳酸氢钠和次氯酸;
(4)根据溶液中的电荷守恒和物料守恒来计算;
(5)将a molL﹣1L的醋酸溶液与b molL﹣1的氢氢化钠溶液等体积混合,溶液呈中性,说明酸过量,酸和氢氧化钠溶液发生反应CH3COOH+NaOH=CH3COONa+H2O,则溶液中c(CH3COOH)=![]() molL﹣1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7 molL﹣1,c(Na+)=c(CH3COO-)=
molL﹣1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7 molL﹣1,c(Na+)=c(CH3COO-)=![]() molL﹣1,则K=
molL﹣1,则K=![]() ;
;
(6)①根据质子守恒分析解答;②根据溶液中的电荷守恒书写.
(1)据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO> HCO3-,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;
(2)0.1mol·L-1的CH3COOH日溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱,
A.氢离子浓度减小,故不符合题意;
B.加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以![]() 增大,故符合题意;
增大,故符合题意;
C.水的离子积常数不变,故不符合题意;
D.醋酸溶液加水稀稻时酸性减弱,氢离子浓度减小氢氢根离子浓度增大,所以![]() 增大,故符合题意;
增大,故符合题意;
E.醋酸的电离平衡常数不变,故不符合题意;故答案为:BD;
(3)次氯酸的酸性强于碳酸氢根离子离子,反应生成碳酸氢根离子,反应的离子方程式为:ClO-+H2O+CO2=HCO3-+HClO,故答案为:ClO-+H2O+CO2=HCO3-+HClO;
(4)CH3COOH与 CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+) =c(H+)-c(OH-)=10-6mol·L-1-10-8mol·L-1=9.9×10-7mol·L-1,故答案为:9.9×10-7mol·L-1:
(5)将a mol·L-1的酯酸溶液与b mol·L-1的氢氢化钠溶液等体积混合,溶液呈中性,说明酸过量,酸和氢氧化钠溶液发生反应CH3COOH+NaOH=CH3COONa+H2O,则溶液中c(CH3COOH)=![]() molL﹣1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7 molL﹣1,c(Na+)=c(CH3COO-)=
molL﹣1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7 molL﹣1,c(Na+)=c(CH3COO-)=![]() molL﹣1,则K=
molL﹣1,则K=![]() ;故答案为:
;故答案为:![]() ;
;
(6)标准状况下,将1.12LCO2通入100mL1 molL﹣1的NaOH溶液中,1.12LCO2的物质的量为:![]() 氢氧化钠的物质的量为:
氢氧化钠的物质的量为:![]() ,二者好完全反应生成碳酸纳,质子守恒得:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);故答案为:c(HCO3-)+c(H+)。
,二者好完全反应生成碳酸纳,质子守恒得:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);故答案为:c(HCO3-)+c(H+)。


科目:高中化学 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸。原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子,乳酸的摩尔质量为90g/mol,下列有关说法中正确的是( )

A. 电极a为阴极,放出H2
B. 通电一段时间后,硫酸溶液的pH升高
C. A-通过阴离子交换膜从阴极进入浓缩室
D. 对400mLl0g/L乳酸溶液通电后,当外电路通过0.5mole-时浓度,上升为145g.L-1(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
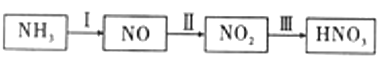
【题目】硝酸工业与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程如图:
I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g)![]() 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为______
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为________(填序号)。
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_________(选填“大于”“等于”或“小于”)二分之一倍的原体积。
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。
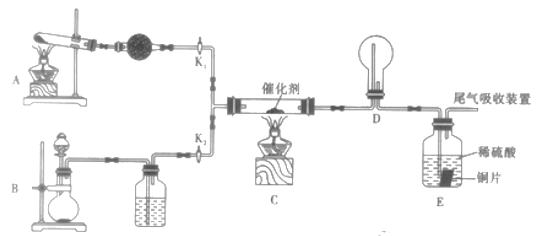
(1)A装置中发生反应的化学方程式为_________________________________。
(2)B装置制备的物质为_________________。(填序号)
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为_______________________。
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下_______L氨气(假设各步反应均完全进行)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积和物质的量浓度均相同的两份Ba(OH)2溶液中,分别滴入等物质的量浓度的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图A、B所示。(忽略温度和体积变化)

(1)曲线B表示滴加的溶液为_________。
(2)d点溶液导电性最弱的原因为__________;ac段发生反应的离子方程式为___________。
(3)曲线A中b点溶液的pH_______曲线B中b点溶液的pH(填“大于”、“小于”或“等于” );a点和c点加入溶液的体积比为_________。
(4)向NaHSO4溶液中滴加Ba(OH)2溶液至溶液恰好呈中性,继续滴加Ba(OH)2溶液时发生反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为________mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用________量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是________
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②可以长期贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是________(填字母)。
A.①②③④ B.②③ C.①③④ D.②③④
(4)下面操作造成所配稀硫酸溶液浓度偏高的是 ________ (填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移 B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.用量筒量取浓硫酸时仰视刻度线
F.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
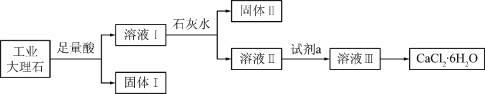
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是常见有机物的表示方法:
①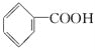 ②
②![]() ③CH4
③CH4
④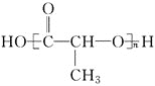 ⑤
⑤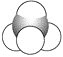
⑥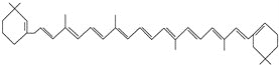
⑦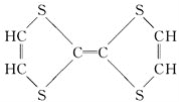
⑧ ⑨
⑨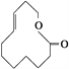
⑩
(1)上述表示方法中属于结构简式的为__________;
属于结构式的为________;
属于键线式的为________;
属于比例模型的为________;
属于球棍模型的为________。
(2)写出⑨的分子式:________。
(3)写出⑩中官能团的电子式:________、________。
(4)②的分子式为________,最简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法或描述正确的是
A. 硫黄矿制备硫酸经历两步:![]()
B. 酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C. 闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
D. 在燃煤中加入石灰石可减少SO2排放,发生的反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
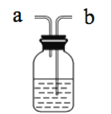
【题目】某学习小组用如图装置研究气体X的性质,气体X的主要成分是Cl2,其中含有少量水蒸气。请回答下列问题:

(1)分别描述B、C装置中的现象____;结合化学方程式及物质性质说明B、C装置中现象不同的原因____。
(2)Cl2是有毒气体,为了防止多余Cl2污染空气,可以在D处用如图装置进行尾气处理,用化学方程式表示该原理____。气体应该由____(填“a”或“b”)管通入。若要吸收224mLCl2(标况下),至少需要1mol/L的上述溶液____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com