
A.在10—15 mL之间
B.恰好在15 mL处
C.小于15 Ml
D.大于15 mL
科目:高中化学 来源: 题型:阅读理解
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(醋酸溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |

查看答案和解析>>
科目:高中化学 来源:全国著名重点中学高考模拟试卷精选 题型:038
如图所示装置来测定样品中砷的含量.其中烧杯A中盛适量的1 mol/L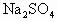 溶液,烧杯B中加搅拌器,以利于测定.
溶液,烧杯B中加搅拌器,以利于测定.

称取5.00 g含砷样品溶解后加入还原剂,将砷全部还原为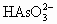 ,除去过量的还原剂后转移到250 mL的容量瓶中配成25 mL溶液.取40 mL适量浓度的KI和
,除去过量的还原剂后转移到250 mL的容量瓶中配成25 mL溶液.取40 mL适量浓度的KI和 混合溶液加入B中.再用移液管取上述含砷溶液10 mL加入B中,边搅拌边电解,电解产生的
混合溶液加入B中.再用移液管取上述含砷溶液10 mL加入B中,边搅拌边电解,电解产生的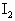 将
将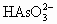 快速地定量地氧化为
快速地定量地氧化为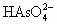 ,以2 mA的电流电解4 min反应完全.反应终点可用________来指示;假定电能没有损失,求样品中
,以2 mA的电流电解4 min反应完全.反应终点可用________来指示;假定电能没有损失,求样品中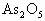 的质量分数.
的质量分数.
(1个电子的电量为1.602×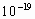 C,
C,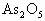 的相对分子质量为229.84)
的相对分子质量为229.84)
查看答案和解析>>
科目:高中化学 来源:浙江省杭州学军中学2010-2011学年高二下学期期中考试化学试题 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com