
【题目】室温下,0.1mol/L的Na2CO3溶液中,下列粒子浓度关系式不正确的是
A. c(Na+)= 2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
B. c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH—)
C. c(H+)= c(OH-)—c(HCO3-)—c(H2CO3)
D. c(Na+)>c(CO32-)> c(OH—)> c(HCO3-)> c(H+)
【答案】C
【解析】
0.1mol/L的Na2CO3溶液中,存在水解平衡:CO32-+H2O![]() HCO3-+OH- HCO3-+H2O
HCO3-+OH- HCO3-+H2O![]() H2CO3+OH-,且第一步水解程度大于第二步水解程度;所以溶液中各离子浓度大小关系为:c(Na+)>c(CO32-)> c(OH—)> c(HCO3-)> c(H+),D正确;溶液中各离子间满足电荷守恒:c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH—),B正确;物料守恒(碳元素守恒):1/2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3), A正确;根据电荷守恒:c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH—)和物料守恒:1/2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3),二者消去c(Na+),得出质子守恒为:c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3),C错误;
H2CO3+OH-,且第一步水解程度大于第二步水解程度;所以溶液中各离子浓度大小关系为:c(Na+)>c(CO32-)> c(OH—)> c(HCO3-)> c(H+),D正确;溶液中各离子间满足电荷守恒:c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH—),B正确;物料守恒(碳元素守恒):1/2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3), A正确;根据电荷守恒:c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH—)和物料守恒:1/2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3),二者消去c(Na+),得出质子守恒为:c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3),C错误;
综上所述,本题选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上可以由N2和H2合成NH3,已知该反应为放热反应。
(1)写出该反应的化学方程式______________。已知:1molN2的共价键断裂吸收的能量为Q1kJ;1molH2的化学键断裂吸收的能量为Q2kJ;形成1molNH3中的化学键释放的能量为Q3kJ。则Q1+3Q2_____2Q3(填“>”、“<”或“=”)。
(2)写出加快合成氨反应速率的措施_______________。
(3)工业上也可通过电解的方法由N2制取NH3:2N2 +6H2O![]() 4NH3 +3O2,若制得8.96L(标准状况下)NH3,转移电子_____mol。
4NH3 +3O2,若制得8.96L(标准状况下)NH3,转移电子_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】索氏制碱又称氨碱法,其主要生产流程如左下图:
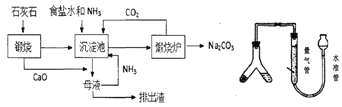
(1)粗盐中常含Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、____、____、盐酸试剂来进行提纯。
(2)用化学方程式表示沉淀池中发生的反应为________________________________。
(3)氨碱法制得的纯碱样品中可能会含有MaCl杂质。现用量气法测定纯碱样品的纯度,(如右上图)如何检查该装置的气密性_________________________________,称取m克样品装入Y型管左侧,量气管中液体应为______________(填字母)。
A.水 B.饱和食盐水 C.饱和碳酸钠溶液 D.饱和碳酸氢钠溶液
(4)若最后测得产生CO2气体的体积为VL(标况下),则样品中纯碱的纯度为_________。若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值_____(填“偏大”,“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获取的信息不正确的是( )
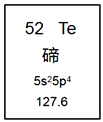
A. 该元素的元素符号为Te
B. 该元素属于金属元素
C. 该元素的原子核外有52个电子
D. 该元素的相对原子质量为127.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数。B原子核内质子数和中子数相等。下列叙述不正确的是( )
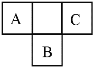
A. C元素是非金属性最强的元素
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. 三种元素的原子半径的大小顺序是:B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用Li-CO2电池,组成为:钌电极/CO2饱和的LiClO4-DMSO电解液/锂片。下列说法不正确的是
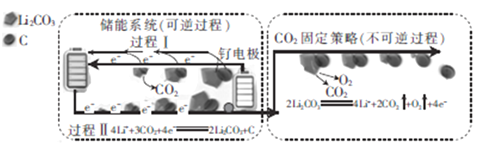
A. Li-CO2电池的电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8 mol e-,生成6 mol气体
C. 过程Ⅱ中化学能转化为电能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-═4Li++3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某稀硫酸和稀硝酸的混合溶液200 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。下列分析或结果正确的是
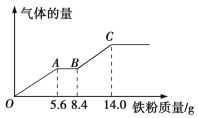
A. 原混合溶液中NO3-的物质的量为0.2 mol
B. OA段产生的是氢气
C. BC段产生NO
D. 原混合溶液中H2SO4的浓度为1.25mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )

选项 | X | 收集气体 | Y |
A | 碱石灰 | 氯气 | 氢氧化钠 |
B | 碱石灰 | 氯化氢 | 氢氧化钠 |
C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com