
【题目】元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获取的信息不正确的是( )
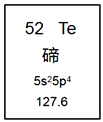
A. 该元素的元素符号为Te
B. 该元素属于金属元素
C. 该元素的原子核外有52个电子
D. 该元素的相对原子质量为127.6
【答案】B
【解析】
根据图中元素周期表可以获得的信息:52表示原子序数;Te表示该元素的元素符号;碲表示元素名称;127.6表示该元素的相对原子质量,进行分析判断即可。
A. 根据元素周期表中的一格可知,该元素的元素符号为Te,A项正确;
B. 根据元素周期表中的一格可知,该元素的名称是碲,带“石”字旁,属于非金属元素,B项错误;
C. 根据元素周期表中的一格可知,左上角的数字为52,表示原子序数为52;根据原子序数=核电荷数=质子数=原子核外电子数,则该元素的原子核外电子数为52,C项正确。
D. 根据元素周期表中的一格可知,127.6表示该元素的相对原子质量,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列化学反应中的说法错误的是( )
A. 化学反应中有物质变化也有能量变化。
B. 化学键断裂吸收能量,化学键生成放出能量。
C. 需要加热的化学反应不一定是吸热反应。
D. 如图所示的反应为放热反应。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质可以实现一步转化的是( )
A. N2→NO2→HNO3→NH4ClB. Al→Al2O3→Al(OH)3→AlCl3
C. Cu→CuCl2→Cu(OH)2→CuOD. Si→SiO2→H2SiO3→NaSiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:![]()
B. 电解饱和食盐水获取烧碱和氯气:![]()
C. 向氢氧化钡溶液中加入稀硫酸:![]()
D. 向碳酸氢铵溶液中加入足量石灰水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成![]() 。
。
(1)请写出金属钒与浓硝酸反应的离子方程式:________________________
(2)灼烧![]() 时可生成钒的氧化物
时可生成钒的氧化物![]() 请写出该反应的化学方程式:_________
请写出该反应的化学方程式:_________
(3)![]() 是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的
是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的![]() 请写出该反应的离子方程式:________________________
请写出该反应的离子方程式:________________________
(4)![]() 是两性氧化物,与强碱反应生成钒酸盐(阴离子为
是两性氧化物,与强碱反应生成钒酸盐(阴离子为![]() ),溶于强酸生成含钒氧离子
),溶于强酸生成含钒氧离子![]() 的盐。请写出
的盐。请写出![]() 分别与烧碱溶液和稀硫酸反应生成的盐的化学式:
分别与烧碱溶液和稀硫酸反应生成的盐的化学式:
______________________
(5)工业上用接触法制硫酸时要用到![]() 。在氧化
。在氧化![]() 的过程中,450℃时发生
的过程中,450℃时发生![]() 与
与![]() 之间的转化:
之间的转化:![]() 说明
说明![]() 在接触法制硫酸过程中所起的作用是________________________
在接触法制硫酸过程中所起的作用是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到实验目的的是
A | B | C | D |
|
|
|
|
分离乙酸乙酯与饱和碳酸钠溶液 | 除去乙炔中的硫化氢 | 检验反应生成的气体中含有乙烯 | 酸性:醋酸>碳酸>硼酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1mol/L的Na2CO3溶液中,下列粒子浓度关系式不正确的是
A. c(Na+)= 2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
B. c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH—)
C. c(H+)= c(OH-)—c(HCO3-)—c(H2CO3)
D. c(Na+)>c(CO32-)> c(OH—)> c(HCO3-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为: CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
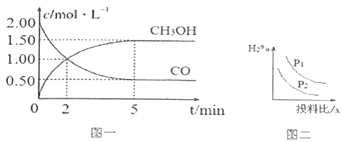
①反应2min到5min,用氢气表示的平均反应速率v(H2)=___________。
②下列说法正确的是______________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高 CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是:______(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3molCH3OH(g),则此平衡将______________移动。(填“向正反应方向”、“不”或“向逆反应方向”)
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,己知:CH3OH、H2的燃烧热(ΔH)分别为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH(l)和H2O(l)的热化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如图所示,下列说法合理的是

A. B中蓝色溶液褪色可以证明还原性: I->SO2
B. 实验完成后,检验A中是否含有Fe2+,可用酸性KMnO4溶液
C. 实验完成后,向A中加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D. 装置C的作用是吸收SO2尾气,发生的反应是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com