
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:![]()
B. 电解饱和食盐水获取烧碱和氯气:![]()
C. 向氢氧化钡溶液中加入稀硫酸:![]()
D. 向碳酸氢铵溶液中加入足量石灰水:![]()
【答案】B
【解析】
A项,题中所给离子方程式电荷不守恒,正确的离子方程式为2Na+2H2O=2Na++20H-+H2↑,故A项错误。
B项,电解饱和食盐水时,氯离子在阳极失电子生成氯气,水电离产生的氢原子在阴极得电子生成氢气,离子方程式为:2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-,故B项正确;
Cl2↑+ H2↑+ 2OH-,故B项正确;
C项,氢氧化钡和稀硫酸反应的化学方程式为Ba(OH)2+H2SO4=BaSO4↓+2H2O,则离子方程式应为:Ba2++2OH-+2H++SO4=BaSO4↓+2H2O,故C项错误。
D项,向碳酸氢铵溶液中加入足量石灰水,NH4+ 、HCO3-均会参与反应,离子方程式应为:NH4++HCO3-+Ca2++2OH-=NH3H2O+CaCO3↓+H2O,故D项错误;
综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】关于反应2Na+2H2O=2NaOH+H2↑的说法错误的是( )
A.属于氧化还原反应
B.金属钠发生还原反应
C.水发生还原反应
D.H2是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性
D. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO
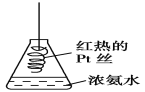
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】索氏制碱又称氨碱法,其主要生产流程如左下图:
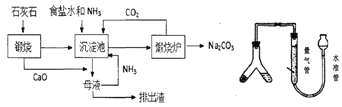
(1)粗盐中常含Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、____、____、盐酸试剂来进行提纯。
(2)用化学方程式表示沉淀池中发生的反应为________________________________。
(3)氨碱法制得的纯碱样品中可能会含有MaCl杂质。现用量气法测定纯碱样品的纯度,(如右上图)如何检查该装置的气密性_________________________________,称取m克样品装入Y型管左侧,量气管中液体应为______________(填字母)。
A.水 B.饱和食盐水 C.饱和碳酸钠溶液 D.饱和碳酸氢钠溶液
(4)若最后测得产生CO2气体的体积为VL(标况下),则样品中纯碱的纯度为_________。若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值_____(填“偏大”,“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是
A. 检验亚硫酸钠试样是否变质:
![]()
B. 除去粗盐中含有的硫酸钙杂质:
![]()
C. 检验某溶液中是否含有![]() :
:
![]()
D. 证明酸性条件下![]() 的氧化性比
的氧化性比![]() 强
强
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获取的信息不正确的是( )
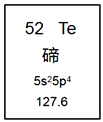
A. 该元素的元素符号为Te
B. 该元素属于金属元素
C. 该元素的原子核外有52个电子
D. 该元素的相对原子质量为127.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用Li-CO2电池,组成为:钌电极/CO2饱和的LiClO4-DMSO电解液/锂片。下列说法不正确的是
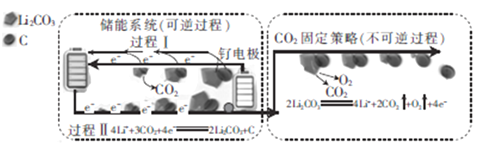
A. Li-CO2电池的电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8 mol e-,生成6 mol气体
C. 过程Ⅱ中化学能转化为电能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-═4Li++3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
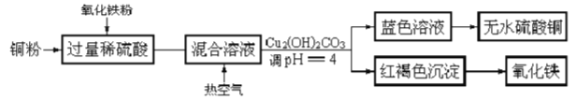
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如上图所示:稀硫酸和氧化铁反应的离子方程式是_________________________;铜和上述反应得到的物质反应的离子方程式是_______________;向混合溶液中通入热空气的反应的离子方程式是____________________;分离蓝色滤液和红褐色沉淀的实验操作是_____________________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:
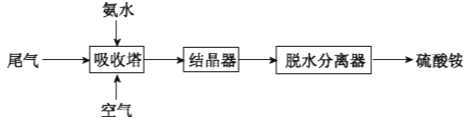
①吸收塔中发生反应的化学方程式是_________。
②检验硫酸铵中的NH4+的操作是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com