
| X | Y | Z | R | |
| 主要化合物 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A、非金属性:Z<R<Y |
| B、T与R可以形成化合物TR2 |
| C、X与R的单质均能使品红溶液褪色 |
| D、T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、在氧化还原反应中,非金属单质一定是氧化剂 |
| B、置换反应一定是氧化还原反应 |
| C、阳离子只能得到电子,阴离子只能失去电子 |
| D、金属阳离子被还原一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
14 6 |
14 6 |
| A、中子数为14 | ||
| B、质子数为14 | ||
| C、核外电子数为14 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
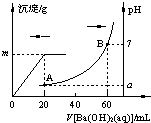 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大质量m=2.33g |
| C、原混合液中c(HCl)=0.2mol?L-1 |
| D、当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
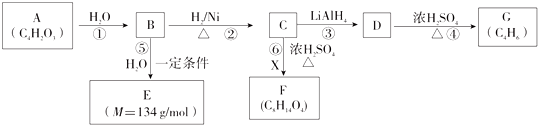
| H2O |
| LiAlH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A
A| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
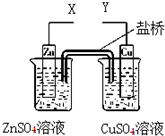
A、若X和Y与电流表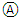 连接,则电流方向:锌电极→ 连接,则电流方向:锌电极→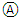 →铜电极 →铜电极 |
B、若X和Y与电流表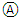 连接,盐桥中的K+向左边烧杯移动 连接,盐桥中的K+向左边烧杯移动 |
| C、若X和Y分别与电源“-”、“+”极相连,Cu极发生氧化反应 |
| D、若X和Y分别与电源“-”、“+”极相连,Zn极质量减轻 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com