
【题目】下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④![]() 的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类
⑦干冰晶体中,一个![]() 分子周围有12个
分子周围有12个![]() 分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
A.①②③⑥B.②③④C.④⑤⑥D.②③⑥⑦
【答案】D
【解析】
①晶体中粒子在三维空间里呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,故①正确;
②含有金属阳离子的晶体是离子晶体或金属晶体,金属晶体是金属阳离子和自由电子构成的,故②错误;
③分子晶体的熔、沸点由分子间作用力决定,与分子中的共价键无关,故③错误;
④离子晶体中离子半径越小,离子所带电荷越多,晶格能越大,MgO和NaCl两种晶体中,半径:Mg2+<Na+,且镁离子带电荷多,则MgO的晶格能较大,所以其熔点比较高,故④正确;
⑤晶胞是描述晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,故⑤正确;
⑥根据晶体的构成微粒将晶体分为分子晶体、原子晶体、离子晶体和金属晶体以及混合型晶体,故⑥错误;
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl晶体中阴阳离子的配位数为8,NaCl晶体中阴阳离子的配位数为6,所以CsCl和NaCl晶体中阴、阳离子的配位数不同,故⑦错误;
所以不正确的有②③⑥⑦;
答案选D。


科目:高中化学 来源: 题型:
【题目】某种 “全氢电池”的工作原理如图所示。下列说法错误的是( )

A.右边吸附层中发生了氧化反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.该电池总反应是H++OH-===H2O
D.电解质溶液中Na+向右移动、ClO4-向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:N2(g)+3H2(g) ![]() 2NH3(g)的正逆反应速率可用反应物或生成物的浓度变化来表示,下列各关系中能说明反应已达平衡状态的是( )
2NH3(g)的正逆反应速率可用反应物或生成物的浓度变化来表示,下列各关系中能说明反应已达平衡状态的是( )
A.v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2 v正(H2)=3v逆(NH3) D.v正(N2)=v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是( )
A.H2(g)+1/2O2(g)![]() H2O(l)ΔH=-285.8kJ·mol-1
H2O(l)ΔH=-285.8kJ·mol-1
B.H2(g)+1/2O2(g)![]() H2O(g)ΔH=-285.8kJ·mol-1
H2O(g)ΔH=-285.8kJ·mol-1
C.2H2(g)+O2(g)![]() 2H2O(l)ΔH=-285.8kJ·mol-1
2H2O(l)ΔH=-285.8kJ·mol-1
D.H2+1/2O2![]() H2OΔH=-285.8kJ·mol-1
H2OΔH=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
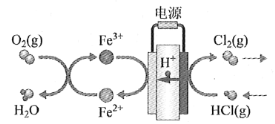
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属的晶胞如图所示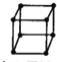 ,其配位数为8
,其配位数为8
B.![]() 分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为
分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为![]() 杂化,是直线型分子
杂化,是直线型分子
C.醋酸钠溶液中离子浓度的关系为:![]()
D.已知反应![]() ,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量
,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量![]() ,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:
,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:![]()
物质 |
|
|
|
浓度 |
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可用沉淀溶解平衡原理解释是( )
A.氢氧化亚铁浊液在空气中放置变红褐色
B.除去水垢中的![]() 要加入
要加入![]()
C.溶洞形成的过程中![]() 与
与![]() 之间的转化
之间的转化
D.含氟牙膏的使用降低了龋齿的发生率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子能大量共存的是
A. pH=12的溶液中:K+、Na+、Br-、![]()
B. 无色溶液中:H+、K+、![]() 、
、![]()
C. c(Fe3+)=0.1mol·L-1的溶液中:K+、H+、SCN-、I-
D. 由水电离出的c(OH-)=1.0×10-13mol·L-1的溶液中:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com