
【题目】下列变化不可用沉淀溶解平衡原理解释是( )
A.氢氧化亚铁浊液在空气中放置变红褐色
B.除去水垢中的![]() 要加入
要加入![]()
C.溶洞形成的过程中![]() 与
与![]() 之间的转化
之间的转化
D.含氟牙膏的使用降低了龋齿的发生率
【答案】A
【解析】
![]() 氢氧化亚铁浊液在空气中放置变红褐色是氢氧化亚铁被氧化生成氢氧化铁,和沉淀溶解平衡无关,选项A符合题意;
氢氧化亚铁浊液在空气中放置变红褐色是氢氧化亚铁被氧化生成氢氧化铁,和沉淀溶解平衡无关,选项A符合题意;
B.碳酸钙溶解度小于硫酸钙,CaSO4中加入碳酸钠可以实现沉淀转化,可用沉淀溶解平衡原理解释,选项B不符合题意;
C.形成溶洞的岩石的成分主要是碳酸钙,碳酸钙难溶于水,存在溶解平衡CaCO3(s)Ca2+(aq)+CO32-(aq),CO32-与二氧化碳、水反应生成可溶性的HCO3-,岩石被逐渐溶解形成溶洞,可用沉淀溶解平衡原理解释,选项C不符合题意;
D. Ca5(PO4)3F溶度积比Ca5(PO4)3OH小,羟基磷酸钙在水中存在平衡:![]() ,含氟牙膏中的
,含氟牙膏中的![]() 与该平衡中的
与该平衡中的![]() 、
、![]() 结合成更难溶的Ca5(PO4)3F,使平衡向右移动,牙齿表面的羟基磷酸钙转化成了氟磷酸钙,使牙齿得到保护,可用沉淀溶解平衡原理解释,选项D不符合题意;
结合成更难溶的Ca5(PO4)3F,使平衡向右移动,牙齿表面的羟基磷酸钙转化成了氟磷酸钙,使牙齿得到保护,可用沉淀溶解平衡原理解释,选项D不符合题意;
答案选A。


科目:高中化学 来源: 题型:
【题目】某小组以CoCl26H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:

①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 mL c1 molL-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 molL-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。 回答下列问题:
(1)装置中安全管的作用原理是___________________。
(2)用NaOH标准溶液滴定过剩的HCl时,一般选用的指示剂为___________。
(3)样品中氨的质量分数表达式为____________________。
(4)测定氯的过程中,使用棕色滴定管的原因是____________________。
(5)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为______。制备X的化学方程式为_____________。X的制备过程中温度不能过高的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④![]() 的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类
⑦干冰晶体中,一个![]() 分子周围有12个
分子周围有12个![]() 分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
A.①②③⑥B.②③④C.④⑤⑥D.②③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() ,关于反应速率的说法正确的是( )
,关于反应速率的说法正确的是( )
A.6mol·L﹣1·s﹣1的反应速率一定比3.5mol·L﹣1·s﹣1的反应速率大
B.反应速率越大,可逆反应进行的越完全
C.恒温恒容下,充入N2,压强增大但正逆反应速率都不变
D.升温或加压都能增大反应物活化分子百分数,从而加快速率
查看答案和解析>>
科目:高中化学 来源: 题型:
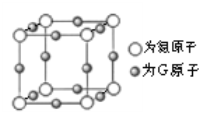
【题目】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答问题:
(1)写出E的基态原子的电子排布式___________。
(2)含有元素D的盐的焰色反应为____色,许多金属形成的盐都可以发生焰色反应,其原因是__________________________________________。
(3)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为____________________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
(4)G与C可形成化合物GC和G2C,已知GC在加热条件下易转化为G2C,试从原子结构的角度解释发生转化的原因________________________。
(5)G与氮元素形成的某种化合物的晶胞结构如下图所示,则该化合物的化学式为__________,氮原子的配位数为__________。若晶体密度为a g·cm-3,则G原子与氮原子最近的距离为__________pm(写出数学表达式,阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如下图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B.C两元素的核电荷数之和是A元素原子序数的4倍。下列说法正确的是
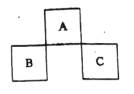
A.C位于元素周期表中第3周期第VA族
B.B的非金属性比A强
C.C的气态氢化物的稳定性比B的强
D.原子半径:r(B)<r(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里研究不同价态硫元素之间的转化
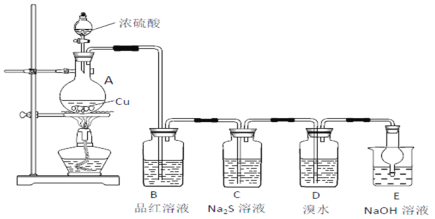
(1)A中发生反应的化学方程式为________________。
(2)B中的现象是__________________。
(3)C中出现淡黄色沉淀,反应中Na2S做____________(填“氧化剂”或“还原剂”)。
(4)D溴水褪色,该反应S元素的价态变化是由+4价变为________________价。
(5)E的作用是_____________,离子方程式为_________________________。
(6)上述实验D体现SO2的性质是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的前四周期元素。已知A和C同主族,B和D同主族。基态A原子核外有6个不同运动状态的电子,D原子次外层电子数等于其余各层电子数之和,基态E原子除最外层只有一个电子外。次外层各能级均为全充满状态。
试回答下列问题:
(1)A元素在形成化合物时,其所成化学键以共价键为主,其原因是____;基态C原子核外自旋方向相同的电子最多有_____个。
(2)元素B第一电离能小于同周期相邻元索的主要原因为_________
(3)写出两个与CB32-具有相同空间构型和键合形式的分子或离子_______。
(4)B与D能形成化合物F,將纯液态F冷却到一定温度下得到一种螺旋状单链结构的固体,如下降所示,则F的化学式为______,此固体中D原子的杂化类型是_______

(5)D与E能形成化合物G,其品胞结构及品胞参数如图所示:
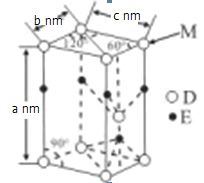
M处的D原子被______个晶胞共用,G的密度为______g/cm3(用含a、b、c、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,有关金属的腐蚀与防护的叙述正确的是

A.钢闸门含铁量高,无需外接电源保护
B.该装置的原理是“牺牲阳极的阴极保护法”
C.将钢闸门与直流电源的负极相连可防止其被腐蚀
D.辅助电极最好接锌质材料的电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com