
【题目】已知A、B、C、D、E为原子序数依次增大的前四周期元素。已知A和C同主族,B和D同主族。基态A原子核外有6个不同运动状态的电子,D原子次外层电子数等于其余各层电子数之和,基态E原子除最外层只有一个电子外。次外层各能级均为全充满状态。
试回答下列问题:
(1)A元素在形成化合物时,其所成化学键以共价键为主,其原因是____;基态C原子核外自旋方向相同的电子最多有_____个。
(2)元素B第一电离能小于同周期相邻元索的主要原因为_________
(3)写出两个与CB32-具有相同空间构型和键合形式的分子或离子_______。
(4)B与D能形成化合物F,將纯液态F冷却到一定温度下得到一种螺旋状单链结构的固体,如下降所示,则F的化学式为______,此固体中D原子的杂化类型是_______

(5)D与E能形成化合物G,其品胞结构及品胞参数如图所示:
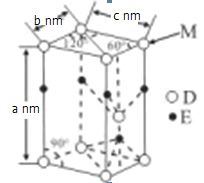
M处的D原子被______个晶胞共用,G的密度为______g/cm3(用含a、b、c、NA的代数式表示)
【答案】碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构 8 氮大于氧是因为N元素原子的2P能级有3个电子,为半满稳定状态,体系能量较低,失去电子需要的能量较高;氟大于氧是因为氟原子半径小于氧原子半径,原子核对最外层电子的吸引力较大,失去电子需要的能量较高 SO3、NO3-、CO32- SO3 sp3 12 ![]()
【解析】
根据已知分析A为C、 B为O 、C为Si、 D为S、 E为Cl。(1)A元素为C在形成化合物时,碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构,所以易形成化学键以共价键为主。C为Si电子排布为1S22S22P63S23P2,基态Si原子核外自旋方向相同的电子最多有8个。
(2)元素B为O ,第一电离能小于同周期相邻元素的主要原因为:氮大于氧是因为N元素原子的2P能级有3个电子,为半满稳定状态,体系能量较低,失去电子需要的能量较高;氟大于氧是因为氟原子半径小于氧原子半径,原子核对最外层电子的吸引力较大,失去电子需要的能量较高。
(3)CB32-的离子式为SiO32-,是由4个原子构成的,与SiO32-具有相同空间构型和键合形式的分子或离子为SO3、NO3-、CO32-
(4)B为O,D为S,O与S能形成化合物F,结构为![]() 由此结构分析,则F的化学式为SO3,D为S原子,其杂化类型是sp3。
由此结构分析,则F的化学式为SO3,D为S原子,其杂化类型是sp3。
(5)由图分析M处的D原子处的键角为60![]() ,每个面能行成6个这样的角,两个面就是12,所以能被12个晶胞共用,G的密度为
,每个面能行成6个这样的角,两个面就是12,所以能被12个晶胞共用,G的密度为![]() g/cm3(用含a、b、c、NA的代数式表示)(已经报错)
g/cm3(用含a、b、c、NA的代数式表示)(已经报错)


科目:高中化学 来源: 题型:
【题目】以丙烯为原料合成抗炎药物D和机体免疫增强制剂Ⅰ的合成路线如下(部分反应条件和产物己经略去):
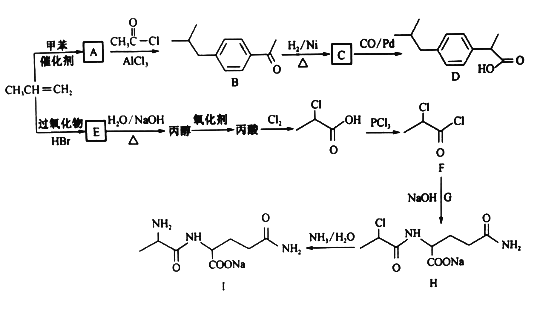
回答下列问题:
(1)由丙烯生成A的反应类型为________,由H生成I的反应类型为______________。
(2)E的结构简式为_____________,F中含氧官能团的名称为___________________。
(3)化合物G的化学式为C5H10O3N2,则其结构简式为___________________。
(4)A→B反应的化学方程式为 ________。
(5)A的同分异构体中属于苯的同系物的共有________种(不包含A),其中核磁共振氢谱有四组峰的
是________ (写一种结构简式)。
(6)已知: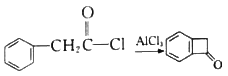 。结合上述流程中的信息,设计由制备
。结合上述流程中的信息,设计由制备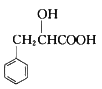 制备
制备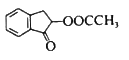 的合成路线:_______________________。
的合成路线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含4mol KNO3和2.5mol H2SO4的某稀溶液中加入1.5mol铁,充分反应后,产生的气体在标准状况下的体积为( )
A. 33.6LB. 28LC. 22.4LD. 11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。
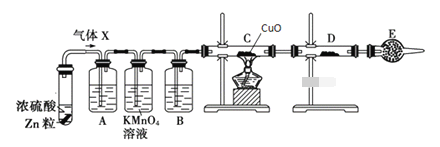
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为__________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)A中加入的试剂可能是______,作用是__________;B中加入的试剂可能是__________,作用是_______;E中加入的试剂可能是__________,作用是__________。
(4)可以证明气体X中含有氢气的实验现象:C中__________,D中__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:

1 mol某烃A通过臭氧氧化并经锌和水处理后只得到
 各1 mol。
各1 mol。
(1)观察题中给出的化学方程式可知:烃分子中每有一个双键,则产物中会有________个羰基(![]() ),产物与烃分子中原子个数相等的元素有________。
),产物与烃分子中原子个数相等的元素有________。
(2)A分子中有________个双键,A的分子式是________________。
(3)已知 可以简写为
可以简写为![]() ,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足。写出A所有可能的结构简式:___________。
,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足。写出A所有可能的结构简式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组查阅资料加。大多数硝酸盐不稳定。受热易分解,分解产物与金属活动顺序有关)了探究硝酸铁分解产物。他们进行如下探究:
(一)探究气体产物
[提出假设]
他们对气体产物提出如下猜想:
猜想1:气体为NO2
猜想2:气体为NO和O2
猜想3:气体为NO和NO2
清想4:气体为NO2和O2
猜想5:气体为NO
(1)他们经过讨论,认为猜想2不成立。理由是_______;根据氧化还原反应原理,不成立的猜想还有__________
[查阅资料]
①几种气体熔点。沸点如下:
气体 | NO | NO2 | O2 |
熔点/℃ | -163.6 | -11.2 | |
沸点/℃ | -151 | 21.1 | -183 |
②2NO2(g) ![]() N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0
[设计实验]
加热装置省略(冰盐冷却剂温度约为-5℃)

取一定量无水硝酸铁粉术进行实验,实验结果: A中U型管收集到少量液体物质;B中排水法收集一部分气体
(2)本实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是___________
(3)实验完毕,取出U型管,打开塞子。观察到有棕色气体产生,则U型管内的气体是_____
向U型管加入_____能吸收该物质。避免污染环境。
(4)检验B瓶收集气体为氧气的操作方法是__________
(二)探究固体成分
分析固体中铁元素价态,可能有种情况:①+2价②+3价③+2价和+3价。
为了探究固体中铁元素价态。甲、乙同学设计如下方案:
步骤 | 现象 | |
甲 | 取少量样品于试管,加入适量稀硫酸使固体完全溶解,再滴加酸性高锰酸钾溶液 | 溶液无明显颜色变化 |
乙 | 取少量样品于试管,加入稀盐酸使固体完全溶解,滴加KSCN溶液 | 溶液变红色 |
(5)上述实验,不能确定固体成分的实验是______(填“甲”或“乙”);根据上迷实验结论。写出硝酸铁分解反应的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了进一步改善北京地区的环境质量,下列做法不正确的是
A.推广使用无磷洗衣粉
B.使用清洁燃料的公交车
C.减少含硫化石燃料的大量燃烧
D.使用不易降解的一次性塑料餐具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是( )
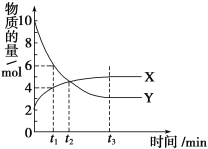
A. 反应的化学方程式为3X(g)![]() 7Y(g)
7Y(g)
B. t1时,Y的浓度是X浓度的1.5倍
C. t2时,正、逆反应速率相等
D. 0到t1时间段内,Y的平均反应速率为4/t1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铬元素(Cr)化合价为+6价,则铅元素(Pb)的化合价为( )
A.+1B.+2C.+3D.+4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com