
【题目】某学习小组查阅资料加。大多数硝酸盐不稳定。受热易分解,分解产物与金属活动顺序有关)了探究硝酸铁分解产物。他们进行如下探究:
(一)探究气体产物
[提出假设]
他们对气体产物提出如下猜想:
猜想1:气体为NO2
猜想2:气体为NO和O2
猜想3:气体为NO和NO2
清想4:气体为NO2和O2
猜想5:气体为NO
(1)他们经过讨论,认为猜想2不成立。理由是_______;根据氧化还原反应原理,不成立的猜想还有__________
[查阅资料]
①几种气体熔点。沸点如下:
气体 | NO | NO2 | O2 |
熔点/℃ | -163.6 | -11.2 | |
沸点/℃ | -151 | 21.1 | -183 |
②2NO2(g) ![]() N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0
[设计实验]
加热装置省略(冰盐冷却剂温度约为-5℃)

取一定量无水硝酸铁粉术进行实验,实验结果: A中U型管收集到少量液体物质;B中排水法收集一部分气体
(2)本实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是___________
(3)实验完毕,取出U型管,打开塞子。观察到有棕色气体产生,则U型管内的气体是_____
向U型管加入_____能吸收该物质。避免污染环境。
(4)检验B瓶收集气体为氧气的操作方法是__________
(二)探究固体成分
分析固体中铁元素价态,可能有种情况:①+2价②+3价③+2价和+3价。
为了探究固体中铁元素价态。甲、乙同学设计如下方案:
步骤 | 现象 | |
甲 | 取少量样品于试管,加入适量稀硫酸使固体完全溶解,再滴加酸性高锰酸钾溶液 | 溶液无明显颜色变化 |
乙 | 取少量样品于试管,加入稀盐酸使固体完全溶解,滴加KSCN溶液 | 溶液变红色 |
(5)上述实验,不能确定固体成分的实验是______(填“甲”或“乙”);根据上迷实验结论。写出硝酸铁分解反应的化学方程式______________
【答案】NO和O2不能大量共存 猜想1、3和5 避免强氧化性的NO2腐蚀橡胶管和橡胶塞 NO 氢氧化钠溶液(答案合理即可) 取出U型管,用玻璃片在水槽里盖好集气瓶口,用食指摁住玻璃片。将集气瓶从水槽中移出,正放实验台上,用带火星的木条放在瓶口,若木条复燃,则B气体为氧气(答案合理即可) 乙 4Fe(NO3)![]() 2Fe2O3+12NO2↑+3O2
2Fe2O3+12NO2↑+3O2
【解析】
(1)猜想2:气体为NO和O2是不合理的,因为2NO+O2=2NO2。根据氧化还原反应原理,猜想1:气体为NO2,猜想3:气体为NO和NO2,猜想5:气体为NO不成立,不符合氧化还原反应的规律。答案:NO和O2不能大量共存 猜想1、3和5。
(2)因为无水硝酸铁粉受热分解会产生NO2等强氧化性气体,所以实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是避免强氧化性的NO2腐蚀橡胶管和橡胶塞。
(3)实验完毕,取出U型管,打开塞子。观察到有棕色气体产生,发生了2NO+O2=2NO2反应,所以U型管内的气体是NO。向U型管通入氧气和水,使NO全部反应生成硝酸,或通空气,再加入氢氧化钠溶液能吸收该物质。
(4)检验B瓶收集气体为氧气的操作方法是取出U型管,用玻璃片在水槽里盖好集气瓶口,用食指摁住玻璃片。将集气瓶从水槽中移出,正放实验台上,用带火星的木条放在瓶口,若木条复燃,则B气体为氧气。
甲实验:取少量样品于试管,加入适量稀硫酸使固体完全溶解,再滴加酸性高锰酸钾溶液,溶液无明显颜色变化,说明不存在Fe2+,②+3价成立。乙实验:取少量样品于试管,加入稀盐酸使固体完全溶解,滴加KSCN溶液,溶液变红色,说明溶液中有Fe3+存在,不能证明Fe2+存在。所以不能确定固体成分的实验是乙。硝酸铁分解反应的化学方程式:4Fe(NO3)![]() 2Fe2O3+12NO2↑+3O2,答案:乙 4Fe(NO3)
2Fe2O3+12NO2↑+3O2,答案:乙 4Fe(NO3)![]() 2Fe2O3+12NO2↑+3O2。
2Fe2O3+12NO2↑+3O2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性比较:图甲可通过观察___________,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理,其理由是_____________。
(2)定量比较:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的前四周期元素。已知A和C同主族,B和D同主族。基态A原子核外有6个不同运动状态的电子,D原子次外层电子数等于其余各层电子数之和,基态E原子除最外层只有一个电子外。次外层各能级均为全充满状态。
试回答下列问题:
(1)A元素在形成化合物时,其所成化学键以共价键为主,其原因是____;基态C原子核外自旋方向相同的电子最多有_____个。
(2)元素B第一电离能小于同周期相邻元索的主要原因为_________
(3)写出两个与CB32-具有相同空间构型和键合形式的分子或离子_______。
(4)B与D能形成化合物F,將纯液态F冷却到一定温度下得到一种螺旋状单链结构的固体,如下降所示,则F的化学式为______,此固体中D原子的杂化类型是_______

(5)D与E能形成化合物G,其品胞结构及品胞参数如图所示:
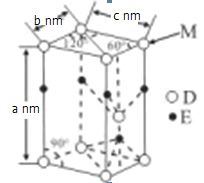
M处的D原子被______个晶胞共用,G的密度为______g/cm3(用含a、b、c、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素分别位于三个周期,它们的原子序数依次增大。A与D同主族,B与E同主族,C与F同主族。且C与F能形成原子个数比为2∶1的化合物M和原子个数比为3:1的化合物N。已知E元素为地壳中含量居第2位的元素,D为金属。
(1)写出下列元素符号:A__________,B__________,C__________,D__________,E__________,F__________。
(2)M能在一定条件下生成N,写出反应的化学方程式:__________。
(3)写出F在元素周期表中的位置:__________。
(4)写出工业上用B来制备单质E的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+ 电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第________ 周期________ 族.
(2)Z元素的符号是 ________ ,其在自然界中常见的二元化合物是________ (写化学式) .
(3)X与M的单质在高温下反应的化学方程式为________,产物分子为直线形,其化学键属___ 共价键(填“极性”或“非极性”).
(4)四种元素中的________(写名称) 可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为_____,B在周期表中的位置____。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146g·mol-1,该物质的化学式为___。已知DBn 在温度高于45度时为气态。DBn属于____晶体。
(3)C与氢元素组成1:1的化合物,与水发生剧烈反应生成一种气体,写出该反应化学反应方程式_______。
(4)D元素的+4价含氧酸钠盐,该钠盐在空气中容易变质,设计实验方案证明该盐已经变质____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,发生反应2HI(g)![]() H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是
H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是
A. 平衡时,各容器的压强:②=①=③
B. 平衡时,I2的浓度:②>①=③
C. 平衡时,I2的体积分数:②>①=③
D. 从反应开始到达平衡的时间:①>②=③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com