
����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�طֱ�λ����������,���ǵ�ԭ��������������A��Dͬ����,B��Eͬ����,C��Fͬ���塣��C��F���γ�ԭ�Ӹ�����Ϊ2��1�Ļ�����M��ԭ�Ӹ�����Ϊ3:1�Ļ�����N����֪EԪ��Ϊ�ؿ��к����ӵ�2λ��Ԫ��,DΪ������
��1��д������Ԫ�ط���:A__________,B__________,C__________,D__________,E__________,F__________��
��2��M����һ������������N,д����Ӧ�Ļ�ѧ����ʽ:__________��
��3��д��F��Ԫ�����ڱ��е�λ��:__________��
��4��д����ҵ����B���Ʊ�����E�Ļ�ѧ����ʽ:__________��
���𰸡�H C O Na Si S 2SO2+O2![]() 2SO3 ��3���ڢ�A�� C+SiO2
2SO3 ��3���ڢ�A�� C+SiO2![]() Si+2CO��
Si+2CO��
��������
A��B��C��D��E��F���ֶ�����Ԫ�طֱ�λ���������ڣ����ǵ�ԭ����������������AΪHԪ�أ�A��Dͬ���壬ԭ������������2����DΪNa��EԪ��Ϊ�ؿ��к����ӵ�2λ��Ԫ�أ���EΪSi��B��Eͬ���壬��BΪ̼Ԫ�أ�C��Fͬ���壬��C��F���γ�ԭ�Ӹ�����Ϊ2��1�Ļ�����M��ԭ�Ӹ�����Ϊ3��1�Ļ�����N����CΪOԪ�ء�FΪSԪ�أ�MΪSO2��NΪSO3���ݴ˽��
(1)A��B��C��D��E��F���ֶ�����Ԫ�طֱ�λ���������ڣ����ǵ�ԭ����������������AΪHԪ�أ�A��Dͬ���壬ԭ������������2����DΪNa��EԪ��Ϊ�ؿ��к����ӵ�2λ��Ԫ�أ���EΪSi��B��Eͬ���壬��BΪ̼Ԫ�أ�C��Fͬ���壬��C��F���γ�ԭ�Ӹ�����Ϊ2��1�Ļ�����M��ԭ�Ӹ�����Ϊ3��1�Ļ�����N����CΪOԪ�ء�FΪSԪ�أ�MΪSO2��NΪSO3��
(2)MΪSO2��NΪSO3��M����һ������������N�Ļ�ѧ����ʽ��2SO2+O2![]() 2SO3��
2SO3��
(3)FΪSԪ�أ��������ڱ��е������ڢ�A�壻
(4)��ҵ����̼�ڸ����»�ԭ���������Ƶþ���Si��������Ӧ�Ļ�ѧ����ʽΪC+SiO2![]() Si+2CO����
Si+2CO����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I����ˮMgBr2����������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��װ����ͼ1��

��Ҫ�������£�
����1 ����ƿ��װ��10gþм��150mL��ˮ���ѣ�װ��B�м���15mLҺ�塣
����2����ͨ�����ĵ�����ֱ������ȫ��������ƿ�С�
����3��Ӧ��Ϻ�ָ������£����˳�ȥþ����Һת������һ�������ƿ�У���ȴ��0�棬�������壬�ٹ��˵������Ѻ��廯þ��Ʒ��
����4�������ñ��ܽ��Ʒ����ȴ��0�棬�������壬���ˣ�ϴ�ӵ������Ѻ��廯þ��������160��ֽ����ˮMgBr2��Ʒ��
��֪����Mg��Br2��Ӧ���ҷ��ȣ�MgBr2����ǿ��ˮ�ԡ�
��MgBr2+3C2H5OC2H5![]() MgBr2��3C2H5OC2H5
MgBr2��3C2H5OC2H5
��ش�
��1������A��������____________��ʵ���в����ø�������������N2��ԭ����___________��
��2���罫װ��B��Ϊװ��C��ͼ2�������ܻᵼ�µĺ����_______________________��
��3���йز���4��˵������ȷ����___________��
A������95%���Ҵ����汽�ܽ��Ʒ B��ϴ�Ӿ����ѡ��0��ı�
C��������160�����ҪĿ���dz�ȥ�� D���ò����Ŀ���dz�ȥ���ѺͿ��ܲ�������
��4��Ϊ�ⶨ��Ʒ�Ĵ��ȣ�����EDTA����дΪY������Һ�ζ�����Ӧ�����ӷ���ʽ��Mg2++Y4-=MgY2-
�ٵζ�ǰ��ϴ�ζ��ܵIJ���������____________________________��
�ڲⶨǰ���ȳ�ȡ0.2500g��ˮMgBr2��Ʒ���ܽ����0.0500mol��L-1��EDTA����Һ�ζ����յ㣬����EDTA����Һ26.50mL��������ˮMgBr2��Ʒ�Ĵ�����________________________��������������ʾ����
��II��������Mg5Al3(OH)19(H2O)4������������ȼ���ϣ�����ʱ�����»�ѧ����ʽ�ֽ⣺
2Mg5Al3(OH)19(H2O)4=27H2O+10MgO+3Al2O3
��1��д���û���������ȼ������������__________________��_____________________��
��2�������ӷ���ʽ��ʾ��ȥ���������Al2O3��ԭ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ��CaCO3������Һ��c(Ca2+)Ϊ5.3��10-5mol/L��MgCO3�ı�����Һ��c(Mg2+)Ϊ2.6��10-3mol/L.����5mLŨ�Ⱦ�Ϊ0.01mol/L��CaCl2��MgCl2��Һ�У���μ���5mL 0.012mol/LNa2CO3��Һ����ַ�Ӧ����˵õ���ҺM�ͳ���N(��������Һ����ı仯)�����й۵㲻��ȷ����
A. 25��ʱ��Ksp(CaCO3)=2.8��10-9
B. ����Na2CO3��Һ�Ĺ����У�������CaCO3����
C. ��ҺM��:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-)
D. ��ҺM��: 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.2 molij��A�������г��ȼ�պ����ɻ�����B��C��1.2 mol����ش��������⣺
(1)��A�ķ���ʽΪ________��
(2)����A����ʹ��ˮ��ɫ������һ�������£�������������ȡ����Ӧ����һ�ȴ���ֻ��һ�֣�����A�Ľṹ��ʽΪ________________��
(3)����A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4��������A�����еĽṹ��ʽΪ___________��
(4)��A������̼ԭ�ӵ�A��ϩ��ͬϵ���ͬ���칹�干��________�֣�����ֻ����һ�����Ľṹ��ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��������ϼӡ�����������β��ȶ��������ֽ⣬�ֽ����������˳���й�)��̽���������ֽ������ǽ�������̽��:
��һ��̽���������
[�������]
���Ƕ��������������²���:
����1:����ΪNO2
����2:����ΪNO��O2
����3:����ΪNO��NO2
����4:����ΪNO2��O2
����5:����ΪNO
��1�����Ǿ������ۣ���Ϊ����2��������������_______������������ԭ��Ӧԭ�����������IJ��뻹��__________
[��������]
�ټ��������۵㡣�е�����:
���� | NO | NO2 | O2 |
�۵�/�� | -163.6 | -11.2 | |
�е�/�� | -151 | 21.1 | -183 |
��2NO2(g) ![]() N2O4(g)(��ɫ) ��H<0
N2O4(g)(��ɫ) ��H<0
[���ʵ��]
����װ��ʡ��(������ȴ���¶�ԼΪ-5��)

ȡһ������ˮ��������������ʵ�飬ʵ����: A��U���ռ�������Һ��������B����ˮ���ռ�һ��������
��2����ʵ�����կ�����ܽӿڴ���������ֽ��������Ŀ����___________
��3��ʵ����ϣ�ȡ��U�ܣ������ӡ��۲쵽����ɫ�����������U���ڵ�������_____
��U�ܼ���_____�����ո����ʡ�������Ⱦ������
��4������Bƿ�ռ�����Ϊ�����IJ���������__________
(��)̽������ɷ�
������������Ԫ�ؼ�̬�������������:��+2�ۢ�+3�ۢ�+2�ۺ�+3�ۡ�
Ϊ��̽����������Ԫ�ؼ�̬���ס���ͬѧ������·�����
���� | ���� | |
�� | ȡ������Ʒ���Թܣ���������ϡ����ʹ������ȫ�ܽ⣬�ٵμ����Ը��������Һ | ��Һ��������ɫ�仯 |
�� | ȡ������Ʒ���Թܣ�����ϡ����ʹ������ȫ�ܽ�,�μ�KSCN��Һ | ��Һ���ɫ |
��5������ʵ�飬����ȷ������ɷֵ�ʵ����______(����������������)����������ʵ����ۡ�д���������ֽⷴӦ�Ļ�ѧ����ʽ______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol X�����0.5mol Y��������2L�ܱ������У��������·�Ӧ��3X(g)+Y(g)nZ(g)+2W(g)��2minĩ����0.4mol W���������Z�����ʵ���Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.1molL��1 min��1���Լ���(д���������)
(1)ǰ2min�ڣ���Y��ʾ��ƽ����Ӧ���ʡ�
(2)2minĩʱX��ת���ʡ�
(3)��ѧ����ʽ��Z�Ļ�ѧ������n��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+O2(g)![]() 2SO3(g)���Ʊ��������Ҫ��Ӧ������������ȷ����
2SO3(g)���Ʊ��������Ҫ��Ӧ������������ȷ����
A. ��������ɼӿ�÷�Ӧ�����ʣ��Ӷ����SO2��ת����
B. ����Ӧ��ϵ��ѹǿ����Ӧ����һ������
C. �÷�Ӧ�Ƿ��ȷ�Ӧ�����¶�Խ�ͣ������SO3���ղ���Խ����
D. ��2minʱ���ڣ�SO2��Ũ����6 mol/L��Ϊ3 mol/L��������ͬʱ����ڣ�SO3(g)���ɵ�ƽ������Ϊ1.5 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1.00L�������У�ͨ��һ������N2O4��������ӦN2O4��g��2NO2��g�������¶ȵ����ߣ�����������ɫ����ش��������⣺
��1����Ӧ����H___0����������������С��������100��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60sʱ�Σ���Ӧ����v��N2O4��Ϊ___molL��1s��1��
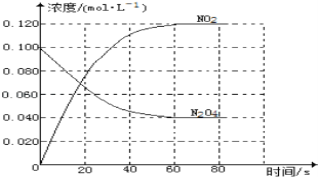
��2��100��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��c��N2O4����0.0020molL��1s��1��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⡣T___100������������������С���������ж�������_______________________��
��3���¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룬ƽ����___����������Ӧ�������淴Ӧ���������ƶ���
��4����2NO2N2O4�Ŀ��淴Ӧ�У�����״̬һ������ƽ��״̬���ǣ�____��
A��N2O4��NO2�ķ�������Ϊ1��2 B��N2O4��NO2��Ũ�����
C��ƽ����ϵ����ɫһ�����ٸı�D����λʱ����1molN2O4��ΪNO2��ͬʱ����2molNO2��ΪN2O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�Ⱦ�Ϊ0.1 mol/L�������ΪV0��HX��HY��Һ���ֱ��ˮϡ�������V��pH��![]() ���仯��ϵ��ͼ��ʾ������������ȷ����
���仯��ϵ��ͼ��ʾ������������ȷ����

A��HX��HY�������ᣬ��HX�����Ա�HY����
B�������£���ˮ�������c(H+)��c��OH -����a<b
C����ͬ�¶��£����볣��K( HX)��a>b
D��![]() =3����ͬʱ��������Һ��������HX ��HY��H2O�Ļӷ�������
=3����ͬʱ��������Һ��������HX ��HY��H2O�Ļӷ�������![]() ��С
��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com