
【题目】对于反应![]() ,关于反应速率的说法正确的是( )
,关于反应速率的说法正确的是( )
A.6mol·L﹣1·s﹣1的反应速率一定比3.5mol·L﹣1·s﹣1的反应速率大
B.反应速率越大,可逆反应进行的越完全
C.恒温恒容下,充入N2,压强增大但正逆反应速率都不变
D.升温或加压都能增大反应物活化分子百分数,从而加快速率
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2。下列关于该电池的说法正确的是

A.电池工作时,镁片作为负极,发生还原反应
B.电池工作时,电子通过电解质溶液由镁电极流向活性炭电极
C.电池工作时,活性炭上电极反应为:O2 + 4e- + 2H2O == 4OH-
D.电池工作时,活性炭电极表面产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
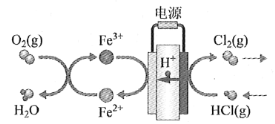
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属的晶胞如图所示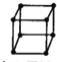 ,其配位数为8
,其配位数为8
B.![]() 分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为
分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为![]() 杂化,是直线型分子
杂化,是直线型分子
C.醋酸钠溶液中离子浓度的关系为:![]()
D.已知反应![]() ,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量
,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量![]() ,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:
,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:![]()
物质 |
|
|
|
浓度 |
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。

(1)反应开始至2min,Y的平均反应速率____________________.
(2)分析有关数据,写出X、Y、Z的反应方程式____________________.
(3)写出提高Y的转化率的两个措施____________________,____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可用沉淀溶解平衡原理解释是( )
A.氢氧化亚铁浊液在空气中放置变红褐色
B.除去水垢中的![]() 要加入
要加入![]()
C.溶洞形成的过程中![]() 与
与![]() 之间的转化
之间的转化
D.含氟牙膏的使用降低了龋齿的发生率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时,AgCl的溶度积K
时,AgCl的溶度积K![]() ,则下列说法正确的是
,则下列说法正确的是![]()
![]()
A.向饱和AgCl水溶液中加入少量的NaCl固体, K![]() 变大
变大
B.![]() 溶液与NaCl溶液混合后的溶液中,一定有 c
溶液与NaCl溶液混合后的溶液中,一定有 c![]() c
c![]()
C.将固体AgCl加入到浓KI溶液中,部分AgCl转化为AgI,故AgCl溶解度小于AgI
D.![]() 时,当溶液中 c
时,当溶液中 c![]() c
c![]() K
K![]() 时,此溶液为AgCl的饱和溶液
时,此溶液为AgCl的饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将![]() 气体通入
气体通入![]() 的NaOH溶液中,下列对所得溶液的描述不正确的是( )
的NaOH溶液中,下列对所得溶液的描述不正确的是( )
A.当![]() 时,所得溶液中一定存在:
时,所得溶液中一定存在:![]()
B.当![]() 时,所得溶液中存在:
时,所得溶液中存在:![]()
C.当![]() 时,所得溶液中存在:
时,所得溶液中存在:![]()
D.当![]() 时,所得溶液中存在:
时,所得溶液中存在:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com