
����Ŀ������ˮ��������߳��ĵ����þƬ������̿Ϊ�缫�����ϵμ�ʳ��ˮ���ر�ɹ�������ط�ӦΪ2Mg+O2+2H2O = 2Mg (OH)2�����й��ڸõ�ص�˵����ȷ����

A.��ع���ʱ��þƬ��Ϊ������������ԭ��Ӧ
B.��ع���ʱ������ͨ���������Һ��þ�缫�������̿�缫
C.��ع���ʱ������̿�ϵ缫��ӦΪ��O2 + 4e- + 2H2O == 4OH-
D.��ع���ʱ������̿�缫�����������
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ����Ũ�ȹ�ϵһ����ȷ���ǣ� ��
A.0.1mol��L��1Na2CO3��Һ�У���ˮϡ�ͣ�![]() ��ֵ��С
��ֵ��С
B.0.1mol��L��1����������Һ�У�c(SO42-)>c(Al3��)>c(H��)>c(OH��)
C.pH��7�İ�ˮ���Ȼ�淋Ļ����Һ�У�c(Cl��)>c(NH4+)
D.pH��2�Ĵ�����Һ��pH��12��NaOH��Һ�������ϣ�c(Na��)��c(CH3COO��)��c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��Ԫ�����ڱ��е�λ����ͼ��ʾ������A��������������������������ȡ�
B | D | |
A | C |
��ش��������⣺
(1)A�����ڱ��е�λ����_____��D���ʵĵ���ʽΪ_____��
(2)C��D������⻯���У��ȶ��Խ�ǿ����_____(�ѧʽ)��C����ۺ�������____(��������������������)�����
(3)A��D�ļ����ӵİ뾶��С��ϵΪ��_____(�û�ѧʽ���)����һ����Ӧ��֤��Ԫ��B��D�ķǽ�����ǿ����ϵ���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����Ҫ�ɷ�ΪBaCO3(��Ca2����Mg2����Fe3��������),ʵ�������ö���ʯ�Ʊ�BaCl2��2H2O����������:
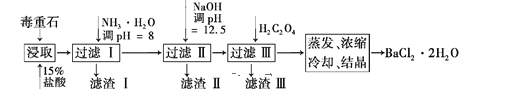
(1)����ʯ�������ȡǰ������ĥ,Ŀ��������Ӵ�����Ӷ�_____________��
(2) ����NH3��H2O����pH=8�ɳ�ȥ____(�����ӷ���)����ʱ����Һ�и����ӵ�Ũ��Ϊ______mol��L��1���ټ���NaOH��pH=12.5,��Һ��ʣ�����������______��ȫ����,____���ֳ��� (�����ӷ���)������H2C2O4ʱӦ�������,ԭ����____����֪:Ksp(BaC2O4)=1.6��10��7,Ksp(CaC2O4)=2.3��10��9, Ksp��Fe(OH)3�� =2.6��10��39��

(3����Na2S2O5���ж��ԣ���˹��Ҷ�����ʳƷ�е��������ϸ�Ĺ涨��ij��ѧ��ȤС���ڲⶨij�����Ѿ���Na2S2O5�IJ�����ʱ��ȡ40mL���Ѿ���Ʒ����ƿ�У����뼸�ε�����Һ����0.02 mol��L��1��ı���Һ�ζ����յ㣬���ĵ����Һ5mL����ζ��յ������Ϊ__________��Na2S2O5�ĺ�������SO2������ģ������Ʒ��Na2S2O5�IJ�������![]() ��Ϊ______
��Ϊ______![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4��һ�ֶ�Ԫ���ᡣ��������H2C2O4��Һ�еμ�NaOH��Һ�����Һ��lgX��pH�ı仯��ϵ��ͼ��ʾ������˵������ȷ����(����)
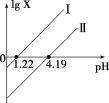
A.�ߢ���X��ʾ����![]()
B.�ߢ��б�ʾ�Ϊ1
C.c(HC2O42-) > c(C2O42-) > c(H2C2O4)��Ӧ��ҺpH��1.22 < pH < 4.19
D.c(Na��)��c(HC2O4-)��2c(C2O42-)��Ӧ��Һ��pH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)Ϊ�Ϻ�ɫ��ĩ,��һ������Ч��������K2FeO4������ˮ,����ŨKOH��Һ,��0~5 ���ǿ������Һ�н��ȶ���һ���Ʊ�����������Cl2��KOH��Һ��20 �����·�Ӧ����KClO(�ڽϸ��¶���������KClO3),KClO����KOH��Fe(NO3)3��Һ��Ӧ�����Ƶ�K2FeO4��ʵ��װ����ͼ��ʾ:

�ش���������:
(1) �Ʊ�KClO��
��װ��B������_______��
��װ��C��������ƿ���ڱ�ˮԡ�е�Ŀ����________��
(2) �Ʊ�K2FeO4��
��װ��C�еõ�����KClO��,��������ƿ�ϵĵ���ȡ��,����KOH��Һ��Fe(NO3)3��Һ,ˮԡ���Ʒ�Ӧ�¶�,����,����Һ��Ϊ�Ϻ�ɫ,�÷�Ӧ�����ӷ���ʽΪ______��
����װ��C�м��뱥��KOH��Һ,�����Ϻ�ɫ����,���ˡ�
(3) �ⶨK2FeO4���ȡ�
�ⶨ�Ʊ���K2FeO4�Ĵ��ȿ��õζ���,�ζ�ʱ�йط�Ӧ�����ӷ���ʽΪ:a. ![]() +
+ ![]() +2H2O=
+2H2O= ![]() +Fe(OH)3��+OH��b.2
+Fe(OH)3��+OH��b.2![]() +2H+=
+2H+= ![]() +H2O��c.
+H2O��c. ![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O����ȡ2.0g �Ʊ���K2FeO4��Ʒ��������KOH ��Һ��,����������KCrO2,��ַ�Ӧ�����,��Һ��250 mL ����ƿ�ж��ݡ�ȡ25.00 mL ����ϡ�����ữ,��0.10 mol��L-1��(NH4)2Fe(SO4)2 ����Һ�ζ����յ�,�ظ�����2��,ƽ������(NH4)2Fe(SO4)2��Һ�����Ϊ24.00 mL,���K2FeO4 ��Ʒ�Ĵ���Ϊ______��
+6Fe2++14H+=2Cr3++6Fe3++7H2O����ȡ2.0g �Ʊ���K2FeO4��Ʒ��������KOH ��Һ��,����������KCrO2,��ַ�Ӧ�����,��Һ��250 mL ����ƿ�ж��ݡ�ȡ25.00 mL ����ϡ�����ữ,��0.10 mol��L-1��(NH4)2Fe(SO4)2 ����Һ�ζ����յ�,�ظ�����2��,ƽ������(NH4)2Fe(SO4)2��Һ�����Ϊ24.00 mL,���K2FeO4 ��Ʒ�Ĵ���Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����CoCl26H2O���������⡢Һ�����Ȼ�粒���Ϊԭ�ϣ��ڻ���̿���£��ϳ��˳Ȼ�ɫ����X��Ϊȷ������ɣ���������ʵ�飺

�ٰ��IJⶨ����ȷ��ȡw g X��������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ�������10% NaOH��Һ��ͨ��ˮ����������Ʒ��Һ�еİ�ȫ����������V1 mL c1 molL-1��������Һ���ա�����������ȡ�½���ƿ����c2 molL-1 NaOH����Һ�ζ���ʣ��HCl�����յ�ʱ����V2 mL NaOH��Һ��
���ȵIJⶨ��ȷ��ȡ��ƷX�����Һ����AgNO3����Һ�ζ���K2CrO4��ҺΪָʾ����������ש��ɫ����������ʧΪ�յ㣨Ag2CrO4Ϊש��ɫ���� �ش��������⣺
��1��װ���а�ȫ�ܵ�����ԭ����___________________��
��2����NaOH����Һ�ζ���ʣ��HClʱ��һ��ѡ�õ�ָʾ��Ϊ___________��
��3����Ʒ�а���������������ʽΪ____________________��
��4���ⶨ�ȵĹ����У�ʹ����ɫ�ζ��ܵ�ԭ����____________________��
��5�����ⶨ����ƷX���ܡ������ȵ����ʵ���֮��Ϊ1��6��3���ܵĻ��ϼ�Ϊ______���Ʊ�X�Ļ�ѧ����ʽΪ_____________��X���Ʊ��������¶Ȳ��ܹ��ߵ�ԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�Ȼ��Ƶľ���ṹģ�ͣ�����˵������ȷ����
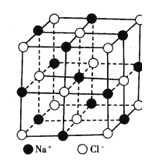
A��NaC1������Na+��C1�� �ĸ�����Ϊ1��1
B��ÿ��Na+��Χ���������C1�� ��Ϊ6
C����Na+��������������C1�� ���ɵĶ���������������
D��ÿ��Na+��Χ���������Na+��Ϊ8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ![]() �����ڷ�Ӧ���ʵ�˵����ȷ���ǣ�������
�����ڷ�Ӧ���ʵ�˵����ȷ���ǣ�������
A.6mol��L��1��s��1�ķ�Ӧ����һ����3.5mol��L��1��s��1�ķ�Ӧ���ʴ�
B.��Ӧ����Խ���淴Ӧ���е�Խ��ȫ
C.���º����£�����N2��ѹǿ�������淴Ӧ���ʶ�����
D.���»��ѹ��������Ӧ�����Ӱٷ������Ӷ��ӿ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com