
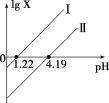
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合液中lgX随pH的变化关系如图所示。下列说法不正确的是( )
A.线Ⅰ中X表示的是![]()
B.线Ⅰ、Ⅱ的斜率均为1
C.c(HC2O42-) > c(C2O42-) > c(H2C2O4)对应溶液pH:1.22 < pH < 4.19
D.c(Na+)=c(HC2O4-)+2c(C2O42-)对应溶液的pH=7
【答案】C
【解析】
A. 二元弱酸草酸的K1=![]() >K2=
>K2=![]() ,当lgX=0时, pH=lgc(H+)=lgK,pH1=1.22<pH2=4.19,表明K1=101.22>K2=104.19,所以直线I中X表示的是
,当lgX=0时, pH=lgc(H+)=lgK,pH1=1.22<pH2=4.19,表明K1=101.22>K2=104.19,所以直线I中X表示的是![]() ,直线Ⅱ中X表示的是
,直线Ⅱ中X表示的是![]() ,故A正确;
,故A正确;
B. pH=0时,c(H+)=1mol/L,lg![]() =lgK1=1.22,lg
=lgK1=1.22,lg![]() =lgK2=4.19,所以直线I、II的斜率均为1,故B正确;
=lgK2=4.19,所以直线I、II的斜率均为1,故B正确;
C. 设pH=a,c(H+)=10a,![]() =
=![]() =10a4.19,当c(HC2O42-) > c(C2O42-)时,10a4.19<1,即a4.19<0,解得:a<4.19,K1·K2=
=10a4.19,当c(HC2O42-) > c(C2O42-)时,10a4.19<1,即a4.19<0,解得:a<4.19,K1·K2=![]() ×
×![]() =
=![]() ,即
,即![]() =
=![]() =102a5.41,当c(C2O42)>c(H2C2O4)时,102a5.41>1即2a5.41>0,解得a>2.705,所以c(HC2O42-) > c(C2O42-) > c(H2C2O4)对应溶液pH 2.705<pH<4.19,故C错误;
=102a5.41,当c(C2O42)>c(H2C2O4)时,102a5.41>1即2a5.41>0,解得a>2.705,所以c(HC2O42-) > c(C2O42-) > c(H2C2O4)对应溶液pH 2.705<pH<4.19,故C错误;
D. 电荷守恒:c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),当c(Na+)=c(HC2O4-)+2c(C2O42-)时,c(H+)=c(OH-),对应pH=7,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】下图中 A、B、C、D 分别是三种烃的分子结构,请回答下列问题:

(1)上图中D是有机物分子的_____模型(填“球棍”或者“比例”)。
(2)烃A及其同系物的分子式符合通式_____(碳原子个数用 n 表示)。
(3)下列关于烃C的叙述正确的是_____(填序号)。
a.分子式为 C6H6,它不能使酸性 KMnO4 溶液褪色,属于饱和烃
b.从分子结构看,C分子中含有碳碳双键,属于烯烃
c.烃C中加入溴水,充分振荡,静置,下层无色
(4)写出 B 使溴水褪色的化学方程式___,该反应类型:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题。
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
【1】铁生锈总反应属于 ( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
【2】关于反应4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3,下列说法正确的是 ( )
4Fe(OH)3,下列说法正确的是 ( )
A.O2发生还原反应
B.Fe(OH)2被还原
C.H2O发生氧化反应
D.H2O是氧化剂
【3】下列反应条件的改变对4Fe+3O2+xH2O![]() 2Fe2O3·xH2O速率的影响不正确的是( )
2Fe2O3·xH2O速率的影响不正确的是( )
A.增大O2的浓度能加快生锈速率
B.潮湿环境中铁生锈的速率更快
C.升高温度能加快生锈速率
D.干燥空气中铁生锈速率更快
【4】下列反应吸收热量的是 ( )
A.铁与稀盐酸反应
B.铁丝在氧气中燃烧
C.铝还原氧化铁
D.碳与二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种 “全氢电池”的工作原理如图所示。下列说法错误的是( )

A.右边吸附层中发生了氧化反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.该电池总反应是H++OH-===H2O
D.电解质溶液中Na+向右移动、ClO4-向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
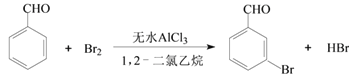
已知:①间溴苯甲醛温度过高时易被氧化。②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
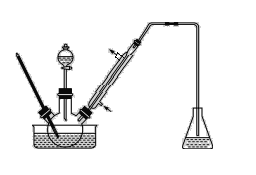
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:分离有机层,收集相应馏分。
(1)实验装置中盛装液溴的仪器名称是_____,锥形瓶中的试剂为NaOH溶液其作用为________。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)___。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤4中采用何种蒸馏方式_______,其目的是为了防止________。
(5)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2。下列关于该电池的说法正确的是

A.电池工作时,镁片作为负极,发生还原反应
B.电池工作时,电子通过电解质溶液由镁电极流向活性炭电极
C.电池工作时,活性炭上电极反应为:O2 + 4e- + 2H2O == 4OH-
D.电池工作时,活性炭电极表面产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:N2(g)+3H2(g) ![]() 2NH3(g)的正逆反应速率可用反应物或生成物的浓度变化来表示,下列各关系中能说明反应已达平衡状态的是( )
2NH3(g)的正逆反应速率可用反应物或生成物的浓度变化来表示,下列各关系中能说明反应已达平衡状态的是( )
A.v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2 v正(H2)=3v逆(NH3) D.v正(N2)=v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属的晶胞如图所示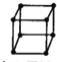 ,其配位数为8
,其配位数为8
B.![]() 分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为
分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为![]() 杂化,是直线型分子
杂化,是直线型分子
C.醋酸钠溶液中离子浓度的关系为:![]()
D.已知反应![]() ,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量
,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量![]() ,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:
,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:![]()
物质 |
|
|
|
浓度 |
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com