
【题目】X、Y、Z三种短周期元素在周期表中的位置如下图所示。若X的最高正价与负价的代数和为2,则下列说法正确是
![]()
A. 原子序数由大到小为 Z >Y>X
B. 氢化物最稳定的元素为Z
C. 最高价氧化物的水化物酸性最强的元素为Z
D. 原子半径由大到小为 Y>Z>X
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】镁铝合金质优体轻,又不易锈蚀,被大量用于航空工业、造船工业、日用化工等领域.下列关于镁铝合金性质的叙述中,正确的是( )
A.此合金的熔点比镁和铝的熔点都高
B.此合金能全部溶解于稀盐酸中
C.此合金能全部溶解于氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、SO![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________(填化学式),充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________(填化学式),充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO![]() ,其原因是__________________。
,其原因是__________________。
(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是________;电解时阳极反应式为_________________。反应Ⅲ的化学方程式为___________________。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是_______________。
②上述步骤3中滴定终点的现象是______________。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果________________(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原ClO2溶液的浓度为 ________mol·L-1(用含字母的代数式表示)。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为___。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确使用药物,可以促进身心健康。人体牙龈出血、患坏血病主要是缺乏________;小苏打可治疗胃酸过多,写出小苏打与胃酸(HCl)反应的离子方程式:
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是( )
A.淀粉和纤维素均为天然高分子化合物
B.饮用矿泉水瓶的主要成分是聚氯乙烯
C.凡含有食品添加剂的食物均不可食用
D.大米煮成粥后,淀粉就变成了葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
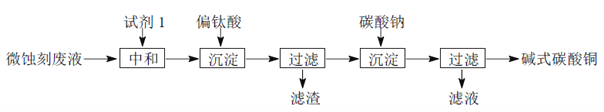
(1)试剂1最好选用________________。
a.Fe2O3 b.CaCO3 C.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式______________________。
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在___________________________。

(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克;⑤称量生成CuO的质量为8.0克。而乙同学认为除步骤②外,实验只需测定四个量中的部分数据即可,则合理的组合为______________(填序号,写一组即可)。根据你的选择,计算出碱式碳酸铜的组成,写出计算过程。____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是( )
选项 | 物质 | 使用的试剂 | 主要操作 |
A | 乙醇(水) | 金属钠 | 过滤 |
B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上不能用于设计原电池反应的是( )
A. Al(OH)3(s)+NaOH(aq)=NaAlO2(aq)+2H2O(l) ΔH<0
B. CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH<0
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH<0
D. H2(g)+Cl2(g)=2HCl(g) ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com