
| A. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| B. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| C. | 制乙炔时,用排水法或向上排空气法收集气体 | |
| D. | 制一氧化氮时,用排空气法收集气体 |
分析 A.氯气和HCl都能和碳酸氢钠反应生成二氧化碳,浓硫酸具有吸水性;
B.用Na2O2或H2O2作反应物制取氧气,应该采用固液混合不加热型装置;
C.乙炔不溶于水,且密度小于空气;
D.NO极易和空气中氧气反应生成二氧化氮.
解答 解:A.氯气和HCl都能和碳酸氢钠反应生成二氧化碳,又引进新的杂质,应该用饱和食盐水除去氯气中的氯化氢,浓硫酸具有吸水性,可以干燥氯气,故A错误;
B.用Na2O2或H2O2作反应物制取氧气时,过氧化钠和水反应生成氧气且不需要加热,过氧化氢在二氧化锰固体作催化剂条件下制取氧气且不需要加热,所以应该采用固液混合不加热型装置,故B正确;
C.乙炔不溶于水,且密度小于空气,所以可以采用排水法或向下排空气法收集乙炔,故C错误;
D.NO极易和空气中氧气反应生成二氧化氮,且NO不溶于水,应该采用排水法收集NO,故D错误;
故选B.
点评 本题以气体制取和收集为载体考查化学实验方案评价,为高频考点,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,知道各个实验原理及基本操作方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 形成酸雨 | B. | 使全球气候变暖 | C. | 破坏臭氧层 | D. | 产生雷电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
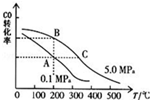 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有4种官能团 | |
| B. | 分子式为C10H8O6 | |
| C. | 1mol分枝酸最多可与2mol乙醇发生酯化反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com