
| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$,结合ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$、PV=nRT分析判断.
解答 解:A.由n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$可知,相同质量时,同温同压下两种气体的体积与摩尔质量呈反比,故A错误;
B.同温同压下,由ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$可知,相同质量的两种气体,摩尔质量越大密度越大,而摩尔质量越大物质的量越小,二者呈反比,故B错误;
C.由ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$可知,同温同压下两种气体的摩尔质量之比等于密度之比,故C正确;
D.由n=$\frac{m}{M}$、PV=nRT可知,同温同体积下两种气体的质量之比等于压强之比的倒数,故D错误.
故选C.
点评 本题考查阿伏加德罗定律及其推论,题目难度中等,注意根据相关公式进行推导,侧重于考查学生的分析推理能力和对公式的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石灰石 | B. | 硝酸、烧碱、胆矾 | ||
| C. | 醋酸、碱式碳酸铜、醋酸钠 | D. | 盐酸、熟石灰、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| B. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| C. | 制乙炔时,用排水法或向上排空气法收集气体 | |
| D. | 制一氧化氮时,用排空气法收集气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
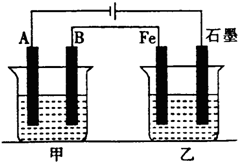 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
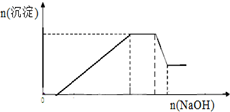 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水、硝酸银溶液、稀硝酸 | B. | 水、氢氧化钠溶液、盐酸 | ||
| C. | 水、氢氧化钾溶液、盐酸 | D. | 水、氢氧化钾溶液、硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com