
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
分析 A.氯气与水的反应,加入水,溶液酸性减弱,促进水的电离;
B.碳酸酸性大于次氯酸,次氯酸大于碳酸氢根离子,加入少量NaHCO3固体和盐酸反应生成二氧化碳气体,和次氯酸不反应;
C.通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,平衡左移,漂白性减弱;
D.根据电荷守恒可知:c(Na+)+c(H+)=c(Cl-))+c(ClO-)+c(OH-),加入少量固体NaOH,溶液为中性时c(Na+)=c(Cl-)+c(ClO-);
解答 解:在氯水中存在如下平衡:Cl2+H2O?HCl+HClO、H2O?H++OH-、HClO?H++ClO-.
A.加入少量水,溶液酸性减弱,促进水的电离,水的电离平衡向正反应方向移动,故A正确.
B.碳酸酸性大于次氯酸,次氯酸大于碳酸氢根离子,加入少量NaHCO3固体和盐酸反应生成二氧化碳气体,促进和谐平衡正向进行,次氯酸浓度增大,次氯酸根离子浓度增大,故B错误;
C.通入少量SO2,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,平衡左移,HClO的浓度减小,溶液漂白性减弱,故C错误;
D.加入少量固体过氧化钠,反应后溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),溶液呈中性,则有:c(H+)=c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故D错误;
故选A.
点评 本题既考查了化学平衡,又考查了电离平衡,注意次氯酸是一种弱电解质,在增加HClO时,其电离程度减小,在水中加酸或碱都抑制了水的电离,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 霾是一种分散系,分散质是固体 | |
| B. | 雾是一种分散系,分散剂是气体 | |
| C. | 霾属于胶体分散系 | |
| D. | 减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
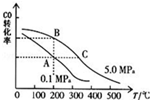 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
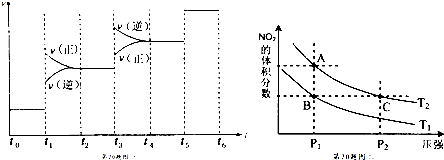
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
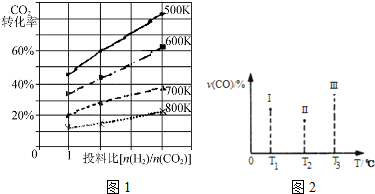
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
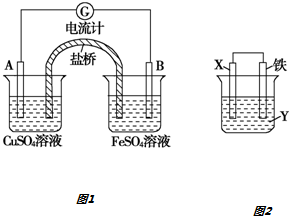
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com