
分析 混合物与盐酸恰好完全反应,反应后的溶液中无Fe3+,说明溶液中的溶质为FeCl2,发生反应:Fe+Fe2O3+6HCl=3FeCl2+3H2O、Fe+2HCl=FeCl2+H2↑,计算生成0.03mol氢气时消耗Fe、HCl的物质的量,设原混合物中Fe2O3的物质的量为xmol,根据化学方程式表示出与氧化铁反应消耗Fe、HCl的物质的量,再根据混合物总质量列方程计算解答.
解答 解:混合物与盐酸恰好完全反应,反应后的溶液中无Fe3+,说明溶液中的溶质为FeCl2,
反应生成0.03mol H2,则:
Fe+2HCl=FeCl2+H2↑
0.03mol 0.06mol 0.03mol
设原混合物中Fe2O3的物质的量为xmol,则:
Fe+Fe2O3+6 HCl=3FeCl2+3H2O
x mol x mol 6x mol
由题意可知,(x+0.03)mol×56g/mol+x mol×160g/mol=3.84g,
解得x=0.01mol,
(1)混合物中m(Fe2O3)=0.01 mol×160 g•mol-1=1.6 g,
故答案为:1.6;
(2)n(HCl)=(6x+0.06)mol=(0.06+0.06)mol=0.12mol,
则c(HCl)=$\frac{0.12mol}{0.12L}$=1mol/L
故答案为:1.
点评 本题考查混合物计算、根据反应方程式进行的计算,难度中等,明确溶液中发生的化学反应是解答本题的关键,注意氧将化铁与盐酸、Fe与氯化铁的反应写成总反应式,可以简化计算.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | L与Q形成的化合物化学式为LQ | |
| B. | L、M的单质与稀盐酸反应剧烈程度:M>L | |
| C. | Q、T的氢化物在常温常压下均为无色气体 | |
| D. | M的最高价氧化物的水化物不具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷的第一电离能高于磷而电负性低于磷 | |
| B. | 三氯化砷与三氯化氮分子都是三角锥构型 | |
| C. | 最高氧化物对应水化物的化学式为HAsO3 | |
| D. | 砷的第一电离能小于同周期硒的电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
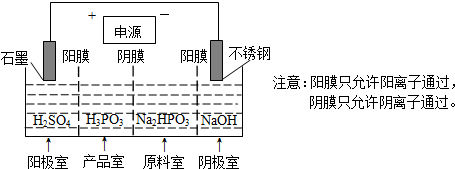
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 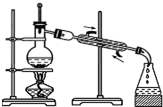 分离沸点相差较大液体混合物 | B. | 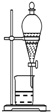 分离互不相溶的两种液体 | ||
| C. | 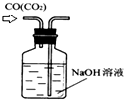 除去CO气体中的CO2气体 | D. | 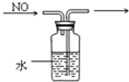 排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | |
| B. | Al→Al2O3→Al(OH)3→NaAlO2 | |
| C. | Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3 | |
| D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com