
���� ��1���������֪24K�Ǵ�����18K�������лƽ���������������ߵı�ֵ��
��2���Ͻ��۵�͡��ӹ���ǿ�ȴ�Ӳ�ȴ���ĥ�𣬻ƽ������ȶ���������Ũ�����Ũ���ᣬ��������Ũ������Ũ�����϶��ɵġ���ˮ����
��3���������ϴ��ʾ�Ľ�������Ĥ���������ڲ������ε���ϴ�����������Լ��٣�˵�������ᷢ���˷�Ӧ��
��4��ͭп�Ͻ���ܶ�С����������������Ӧ�������ܣ�
��� �⣺��1���������֪��18K�������лƽ�����������ǣ�$\frac{18K}{24K}$=75%���ʴ�Ϊ��75%��
��2���ڴ����в����������ϼ��ɹ��ɺϽ𣬺Ͻ��۵�͡��ӹ���ǿ�ȴ�Ӳ�ȴ���ĥ�𣬻ƽ������ȶ���������Ũ�����Ũ���ᣬ��������Ũ������Ũ�����϶��ɵġ���ˮ�����ʴ�Ϊ��ABCD��
��3���ƽ����δ�ʱ����ˣ������䰵������Ϊ���ε�����ϴʱ��ѡ���Լ�Ӧ��ϡ������������ڲ������ε���ϴ�����������Լ��٣�������Ϊ��������ϴҺ�����������Լ������Ե�ʣ�
�ʴ�Ϊ��ϡ������
��4��ͭп�Ͻ���ܶ�С����������������Ӧ�������ܣ���A��B��C������������α��ֻ��D�۲���ɫ���ܣ��ʴ�Ϊ��D��
���� ���⿼�����ʵļ���Ϊ��Ƶ���㣬��ȷ���ʵĻ�ѧ�����ǽ����Ĺؼ���ע����������ʲ��켰����ķ�Ӧ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ijʵ��С������ͼװ���Ʊ���������Һ����̽�������ʣ�
ijʵ��С������ͼװ���Ʊ���������Һ����̽�������ʣ�| ���� | ���� |
| a������ҺpH���������еμ�2�η�̪ | pH=13����Һ��죬5min����ɫ |
| b����������μ������� | ��Һ��ɻ���ɫ |
| ���� | ���� |
| ȡ5mL pH=13NaOH��Һ�������еμ�2�η�̪ | ��Һ��죬30min����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪�缫���ϣ�����ͭ������ʯī��п�������������Һ��CuSO4��Fe2��SO4��3�����ᣮ��Ҫ��ش��������⣺
��֪�缫���ϣ�����ͭ������ʯī��п�������������Һ��CuSO4��Fe2��SO4��3�����ᣮ��Ҫ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����һ�ֿɽ���ľ�����߷��Ӳ��ϣ��ڲ��ϵ����������Է����кܺõ�Ӧ��ǰ����PPG��һ�ֺϳ�·�����£�
����һ�ֿɽ���ľ�����߷��Ӳ��ϣ��ڲ��ϵ����������Է����кܺõ�Ӧ��ǰ����PPG��һ�ֺϳ�·�����£�


 ��
�� ��
�� ��
�� ��
�� �ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2Br$��_{����}^{NaOH/��}$CH2=CH2$��_{����}^{H_{2}O}$CH3CH2OH��
�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2Br$��_{����}^{NaOH/��}$CH2=CH2$��_{����}^{H_{2}O}$CH3CH2OH���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ԭ����������������� | |
| B�� | ԭ��������������ƶ� | |
| C�� | �����£�ǿ��ǿ����ϡ��Һ�з�Ӧ���к�����-57.3KJ��mol-1 | |
| D�� | �ö��Ե缫���CuSO4��Һ�����·��ÿͨ��1mol���ӣ���Һ�оͲ���1mol H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
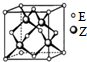 X��Y��Z��R��W��EΪǰ������Ԫ����ԭ��������������X�ĵ�����Y�ĵ����ڷŵ������·�Ӧ����������Ⱦ�R��̬ԭ�ӵ�M�ܲ�����3�ԳɶԵ��ӣ�W������5��δ�ɶԵ��ӣ�Y��Z�ֱ��γ��⻯��Q��J����֪Q��JĦ��������ȣ�Q��ˮ��Һ�м�������WY2�����������������ݣ�Eλ�����ڱ���ds���������ֻ��һ�ԳɶԵ��ӣ���ش��������⣺
X��Y��Z��R��W��EΪǰ������Ԫ����ԭ��������������X�ĵ�����Y�ĵ����ڷŵ������·�Ӧ����������Ⱦ�R��̬ԭ�ӵ�M�ܲ�����3�ԳɶԵ��ӣ�W������5��δ�ɶԵ��ӣ�Y��Z�ֱ��γ��⻯��Q��J����֪Q��JĦ��������ȣ�Q��ˮ��Һ�м�������WY2�����������������ݣ�Eλ�����ڱ���ds���������ֻ��һ�ԳɶԵ��ӣ���ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com