
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是

A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中一定不含CO32-,可能含有SO42-和NO3-
C. 溶液中n(NH4+)=0.2mol
D. 三种离子的物质的量之比为n(H+):n(Al3+):n(Mg2+)=1:1:1
【答案】C
【解析】本题考查的是离子共存和离子推断问题。A,根据电荷守恒可知,溶液中一定有阴离子,所以A错。B,加入锌粒后产生了无色无味无毒的气体,这气体只能是H2,说明溶液中一定有H+和SO42-,一定没有CO32-(不能和H+大量共存)和NO3-(若有,会生成有毒气体),所以B错误。C,加入0.1molNaOH时,没有沉淀生成,进一步说明有H+,且其物质的量为0.1mo;NaOH过量后,白色沉淀没有完全溶解,只溶解了一部分,说明一定有Mg2+和Al3+,一定没有Fe3+(氢氧化铁是红褐色的);加入NaOH在0.5—0.7mol时,沉淀没有变化,说明溶液中一定有NH4+.由NH4++OH- = NH3H2O可知,n(NH4+)=0.2 mol,所以C正确。D,从0.7—0.8可知,溶解氢氧化铝消耗了0.1molNaOH,由Al(OH)3+OH-=AlO2-+2H2O可知,n(Al3+)=0.1mol,,由于沉淀共消耗0.4molNaOH(0.1—0.5),所以n(Mg2+)=0.05mol,所以D错了,


科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
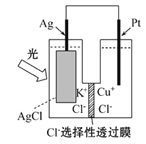
A. Cl-由负极迁移到正极
B. 负极上物质发生还原反应
C. Cu+在负极发生氧化反应
D. 生成108 g银,转移电子个数为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中除Na+外,还含有SO42—、HCO3—、SO32—和Br—等离子,通入足量Cl2,溶液中离子浓度增大的是
A. SO42— B. HCO3— C. SO32— D. Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族.a的原子结构示意图为 ![]() ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为 ![]() ,则下列叙述中正确的是( )
,则下列叙述中正确的是( )
A.原子序数:a>b>c
B.d单质最活泼
C.原子半径:a>c>d
D.最高价氧化物对应的水化物的酸性:d>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中含有 SO2 等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
ⅠCaCO3(s)![]() CO2(g)+CaO (s) △H = + 178.2 kJ/mol
CO2(g)+CaO (s) △H = + 178.2 kJ/mol
ⅡSO2(g)+CaO(s)![]() CaSO3(s) △H = - 402 kJ/mol
CaSO3(s) △H = - 402 kJ/mol
Ⅲ 2CaSO3(s) + O2 (g) + 4H2O(l)![]() 2[CaSO4· 2H2O](s) △H = - 234.2 kJ/mol
2[CaSO4· 2H2O](s) △H = - 234.2 kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式________________________________________________________
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是_______________
a.3个容器中SO2的平衡转化率的大小顺序为:αA > αB > αC
b.当A容器内气体的平均摩尔质量不变时,说明该反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA > tB
d.当 C 容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据上述反应Ⅱ来除硫,将一定量的烟气压缩到一个 20 L的容器中,测得不同温度下,容器内 SO2 的质量(mg)如下表:
时间/min SO2质量/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
T2 | 2100 | 869 | 242 | x | x | x | x |
①在T1温度下,计算20~40min内SO2 的反应速率____________mol/(L· min)。
②若其它条件都相同,则T1______T2(填“>”、 “<” 或 “=”,下同); x _____ 0.06。
③在T2温度下,若平衡后将容器的容积压缩为10 L,则新平衡时SO2的浓度_____原平衡时SO2的浓度(填“>”、 “<” 或 “=”),理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号内为杂质),所用试剂和方法正确的是
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 溴乙烷(乙醇) | 乙酸、浓硫酸 | 蒸馏 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
D | 甲烷(丙烯) | 溴水 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,可以作为2NO2(g)![]() 2NO(g)+O2(g)达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定( )
2NO(g)+O2(g)达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定( )
A. ①③⑤⑦ B. ②④⑤
C. ①③④ D. ①③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com