
【题目】向下列各物质水溶液中滴加稀硫酸或氯化钙溶液时,均有白色沉淀生成的是
A.NaOHB.Na2CO3C.NaClD.Na2SiO3
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】以硫化铜精矿为原料生产CuCl的工艺过程如下:
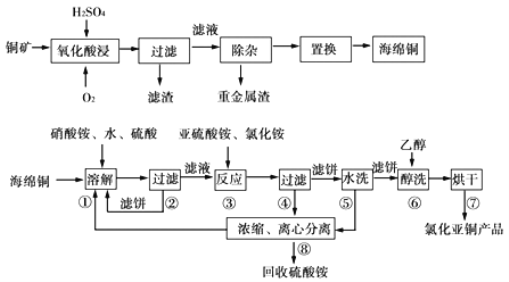
已知CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________,溶解温度应控制在60—70℃,原因是_____________。
(3)写出步骤③中主要反应的离子方程式_____________。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量臼色沉淀,其原因_____________。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中中![]() 为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3![]() K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )

A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是
A.钠燃烧时生成氧化钠B.钠燃烧时发出黄色的火焰
C.铝是地壳里含量最多的金属元素D.在常温下,铝与氧气作用生成致密氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠。下列物质中可以用来生产光导纤维的是
A. 硫 B. 二氧化硅
C. 铁 D. 氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学知识,按要求填空:

(1)上述第一级分类标准(分成A、B组)的依据为:___________。
(2)C组中某一物质常温能与冷水反应,其离子方程式为:_________________。
(3)D组中与水反应时氧化剂和还原剂物质的量之比为1:1的物质,有________(填化学式)。
(4)F组中某一物质的水溶液呈弱碱性,用电离方程式表示呈弱碱性的原因:________。
(5)E组中某一物质的水溶液可使酸性KMnO4溶液褪色,用离子方程式表示褪色的原因:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量固体或气体加入溶液中,反应后溶液的质量减少的是
A.将Al粉投入NaOH溶液B.将Fe粉投入CuSO4溶液
C.将Cl2通入澄清石灰水中D.将Fe粉投入FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市场销售的食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生反应的化学方程式为:_______________________。
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 ____________________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________。
②b中反应所产生的I2的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是__________________ mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70% Cu、25% Al、4% Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Fe与过量的浓 HNO3 反应的离子方程式为_________,得到滤渣 1 的主要成分为__________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为Fe3+,用H2O2 做氧化剂的优点是______。
(3)滤渣 2 的主要成分是 Al(OH)3 和 Fe(OH)3,在生产中利用何种化学原理分离两种沉淀,写出反应的离子方程式_______。
(4)第③步蒸发所需玻璃仪器为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com