
| A. | 向10 mL pH=3的醋酸溶液中加入10 mL pH=11的NaOH溶液,混合液的pH=7 | |
| B. | 实验测定,NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3 | |
| C. | NH4Cl溶液加水稀释过程中c(H+)+c(NH3•H2O)=c(OH-) | |
| D. | 向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
分析 A.pH=3的醋酸溶液中c(CH3COOH)>10-3 mol/L,pH=l1的NaOH溶液中c(NaOH)=10-3 mol/L,等体积混合时酸过量;
B.弱酸的铵盐溶液中,酸越弱,酸根离子水解程度越大,则其铵盐溶液碱性越强;
C.根据电荷守恒和物料守恒判断;
D.AgI的溶解度比AgCl的小,但在浓KCl溶液中,AgCl溶解度会降低.
解答 解:A.pH=3的醋酸溶液和pH=l1的NaOH溶液,醋酸的浓度大于氢氧化钠,等体积混合时醋酸过量,溶液呈酸性,故A错误;
B.NH4HCO3溶液显碱性说明铵根离子的水解程度小于碳酸氢根离子的水解程度,CH3COONH4溶液显中性说明铵根离子的水解程度和醋酸根离子的水解程度相等,所以醋酸根离子的水解程度小于碳酸氢根离子,则酸性CH3COOH>HCO3-,故B正确;
C.溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(Cl-),存在物料守恒c(NH4+)+c(NH3•H2O)=c(Cl-),所以得c(H+)=c(NH3•H2O)+c(OH-),故C错误;
D.在浓KCl溶液中,氯离子的存在抑制氯化银电离,所以AgCl溶解度会降低而导致出现白色沉淀,但不能说明AgCl比AgI更难溶,故D错误;
故选B.
点评 本题考查酸碱混合溶液的定性判断,题目难度中等,根据物料守恒和电荷守恒、盐类的水解、弱电解质的电离等知识来解答,易错选项是D,注意还含有氯离子的溶液抑制氯化银溶解,为易错点.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 232Th转换成233U是化学变化 | |
| B. | 230Th和232Th的化学性质几乎完全相同 | |
| C. | Th元素的质量数是232 | |
| D. | Th元素的相对原子质量是231 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆铁人中学高二上期中化学试卷(解析版) 题型:选择题
在溶液导电性实验装置里,分别注入20mL 6mol·L-1醋酸和20mL 6mol·L-1氨水,灯光明暗
程度相似,如果把这两种溶液混和后再试验则( )
A.灯光明暗程度不变 B.灯光变暗
C.灯光明暗程度变化不明显 D.灯光变亮
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2×10-2mol•L-1 | B. | 1×10-12mol•L-1 | C. | 1×10-2mol•L-1 | D. | 2×10-12mol•L-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol•L-1•min-1 | B. | vB=0.3mol•L-1•min-1 | ||
| C. | vC=0.8mol•L-1•min-1 | D. | vD=1mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水阳极反应式:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| D. | 铅蓄电池放电时的负极反应式为:Pb+SO42--2e-═PbSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | (CH3)2CHCH2CH3 | C. | CH3CH2CH2CH3 | D. | CH3(CH2)4CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH2CH3 | B. | (CH3)2CHCH=CH2 | C. | CH2=CH-CH=CH2 | D. | 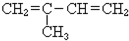 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com