
下列说法正确的是( )。
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+11
D.干冰升华时分子内共价键会发生断裂
科目:高中化学 来源: 题型:
A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),下列说法正确的是 ( )
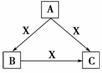
A.若X为Fe,则C可能为Fe(NO3)2
B.若X为KOH溶液,则A可能为Al
C.若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D.若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。其电池反应为2Zn+O2==2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是 ( )
A.锌为正极,空气进入负极反应 B.负极反应为Zn-2e-==Zn2+
C.正极发生氧化反应 D.电解质溶液可以是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于砷(As)元素的叙述中,正确的是
A.第一电离能:As<Se,电负性As<Se
B.在AsCl3分子中,砷和氯原子核外电子数均为8
C.砷酸的酸性比亚砷酸强,且砷酸钠溶液呈碱性
D.AsH3的VSEPR模型为三角锥形,其中As原子采取sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的A、B、C、D、E、F、G七种前四周期元素(稀有气体除外),常温下,有三种元素对应的单质呈气态,C与D同族。其中A原子核外有六种不同运动状态的电子,C为地壳中含量做多的元素,F的简单离子是同周期主族元素形成的简单离子中氧化性最弱的,G的基态原子的最外能层只有一个电子,其他能层均已充满电子。
(1)电负性越大的原子,对键合电子的吸引能力越强,通常对应元素化合价呈现负价。根据B、C、D、E四种元素形成的常见化合物的化合价,确定电负性最大的元素,写出其基态原子的电子排布图 。
(2)甲是由B元素等非金属元素组成的离子化合物,甲可由E的氢化物溶液与电解质乙溶液反应生成,写出该反应的离子方程式 。
(3)A元素可形成多种单质,一种晶体结构如图一所示,该晶体与熔融的F单质相互作用,形成某种青铜色的物质(其中的元素F用“●”表示),原子分布如图二所示,该物质的化学式为 。另一种的晶胞如图三所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为___________g·cm-3(保留两位有效数字)。
 图一 图二 图三 图四
图一 图二 图三 图四
(4)G元素形成的单质,其晶体的堆积模型为________,G的醋酸盐晶体局部结构如图四,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)E和F与不同价态的G可组成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均是由G和E两元素形成的无限长链结构(如下图),已知其中一种化合物的化学式为FGE3,另一种的化学式为 。
(6)若物质F2D3是一种含有非极性共价键的离子化合物,各原子最外层都满足8e-稳定结构,请你写出该化合物阴离子的电子式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.乙烯中C=C的键能是乙烷中C—C的键能的2倍
B.同一原子中,2p,3p,4p能级的轨道依次增多
C. C—O键的极性比N—O键的极性大
D.NH4+中4个N—H键的键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组指定的元素,不能形成AB2型化合物的是( )。
A.2s22p2 和2s22p4 B. 3s23p4 和2s22p4
C.3s2和2s22p5 D. 3s1和3s23p5
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。下列说法不正确的是( )
A.原子半径:Y>Z>W
B.非金属性最强的元素为W
C.Y的最高价氧化物对应的水化物为强酸
D.XW2分子中各原子最外层电子均达到8电子结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com