
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
(方案l)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)图中球形干燥管的作用是__________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_____________。
(3)假设其他操作均正确,按照图装置将导致测定结果_______________(填“偏高”、“偏低”或“无影响”)。
(方案2)用图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
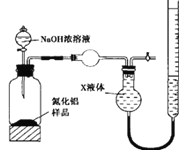
(4)为测定生成气体的体积,量气装置中的X液体最好选择________________。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.浓硫酸
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况)。则AlN的质量分数是___________________(需化简)。
(方案3)按下列路径测定样品中AlN的纯度:

(6)写出步骤反应的离子方程式_____________________。
(7)该方案能否测出AlN的纯度?(若能请用m1,m2列出计算纯度的表达式)__________。
【答案】(1)防倒吸 (2)把装置中残留的氨气全部排入C装置中 (3)偏高 (4)a (5)41V/22400m (6)AlN+OH-+H2O=AlO2-+NH3↑ Al2O3+2OH-=AlO2-+H2O (7)41(m2-m1)/10m1
【解析】
试题(1)氨气是与浓硫酸能发生反应的气体,容易发生倒吸,图C装置中球形干燥管的作用是防倒吸。(2)通入氮气的目的是把装置中残留的反应生成的氨气全部排入C装置中被浓硫酸吸收,准确测定装置C的增重。(3)图1中空气中的水蒸气和二氧化碳进入装置C,使的定结果偏高。(4)a、四氯化碳不能溶解氨气,可以用排四氯化碳溶液的方法收集氨气并测定体积,正确;b、氨气极易溶于水,不能用排水法测定,错误;c、氨气极易溶于水,不能用氯化铵溶液,错误;d、氨气能和浓硫酸反应,错误。所以选a。 (5)根据氮原子守恒,氨气的物质的量就是氮化铝的物质的量,则氮化铝的物质的量为V/22400mol,则氮化铝的质量分数为![]() =41V/22400m(6)从流程分析,氮化铝和氢氧化钠反应生成偏铝酸钠和氨气,离子方程式为:AlN+OH-+H2O=AlO2-+NH3↑ ;氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子方程式为: Al2O3+2OH-=AlO2-+H2O(7)根据反应分析,氮化铝和氧化铝最后都为氧化铝,所以固体增重就为氮化铝变氧化铝造成的,所以根据质量差值计算
=41V/22400m(6)从流程分析,氮化铝和氢氧化钠反应生成偏铝酸钠和氨气,离子方程式为:AlN+OH-+H2O=AlO2-+NH3↑ ;氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子方程式为: Al2O3+2OH-=AlO2-+H2O(7)根据反应分析,氮化铝和氧化铝最后都为氧化铝,所以固体增重就为氮化铝变氧化铝造成的,所以根据质量差值计算
2AlN ~ Al2O3 质量改变20
41×2 (m2-m1)
则氮化铝的质量为41(m2-m1)/10,则氮化铝的质量分数为 41(m2-m1)/10m1


科目:高中化学 来源: 题型:
【题目】用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

(1)用KSCN溶液检验出Fe3+的现象是_______________________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _____________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:

①NaCl溶液的浓度是________ mol·L-1。
②Ⅳ中检测Cl2的实验方法:______________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)俄美科学家联合小组宣布合成出114号元素(FI)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置______________,属于金属元素还是非金属元素?____
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________________。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(1)元素⑦的氢化物与⑧的单质反应的离子方程式为__________。
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________。
(3)元素Fe的单质与⑦的氢化物高温下反应的化学方程式为___________。
(III)判断以下叙述正确的是__________。
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
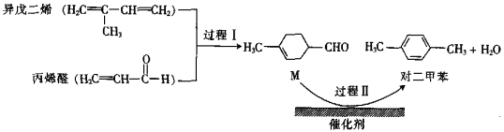
下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出___________kJ 的热量。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1∶2的是 ( )
A. 3S+6NaOH═2Na2S+Na2SO3+3H2O
B. 2CH3COOH+Ca (ClO )2═2HClO+Ca (CH3COO )2
C. I2+2NaClO3═2NaIO3+Cl2
D. 4HCl (浓 )+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式.
(1)铁与水蒸气在高温下:_____
(2)苛性钠腐蚀玻璃:_____
(3)制取漂白粉:_____
(4)稀硝酸与铜片:_____
(5)氨的催化氧化:_____
(6)铜片在浓硫酸中加热:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3![]() 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com