
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
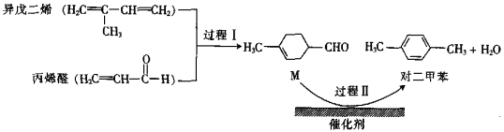
下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
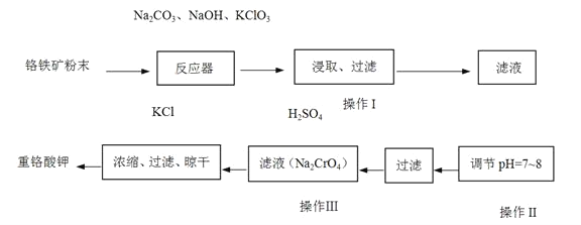
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
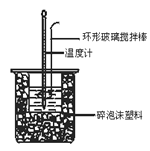
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)元素A、B、C中,电负性最大的是____(填元素符号,下同),元素B、C、D第一电离能由大到小的顺序为________。
(2)与同族其它元素X形成的XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28′(填“>”“<”或“=”),原因是________。
(3)BC3-离子中B原子轨道的杂化类型为____________,BC3-离子的立体构型为________________。
(4)基态E原子的电子排布式为________;C、E形成的化合物EC5(其中E的化合价为+6)中σ键与π键数目之比为________;
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为_____g·cm-3(用NA表示阿伏加德罗常数)。
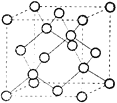
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是
A. 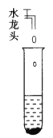 清洗铜与浓硫酸反应后有残液的试管
清洗铜与浓硫酸反应后有残液的试管
B. 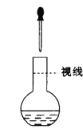 配置一定物质的量浓度的溶液实验中,为定容时的操作
配置一定物质的量浓度的溶液实验中,为定容时的操作
C. 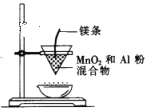 装置制取金属锰
装置制取金属锰
D. 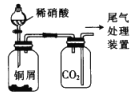 装置为制备并用排气法收集NO气体的装置
装置为制备并用排气法收集NO气体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
(方案l)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)图中球形干燥管的作用是__________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_____________。
(3)假设其他操作均正确,按照图装置将导致测定结果_______________(填“偏高”、“偏低”或“无影响”)。
(方案2)用图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
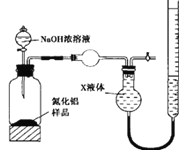
(4)为测定生成气体的体积,量气装置中的X液体最好选择________________。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.浓硫酸
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况)。则AlN的质量分数是___________________(需化简)。
(方案3)按下列路径测定样品中AlN的纯度:

(6)写出步骤反应的离子方程式_____________________。
(7)该方案能否测出AlN的纯度?(若能请用m1,m2列出计算纯度的表达式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年2月18日,FDA批准ChelseaTherapeutics公司的Northera胶囊(屈昔多巴)用于治疗神经源性体位性低血压。下列有关该药物的说法不正确的是( )

A.微溶于水,能溶于稀盐酸,也能溶于氢氧化纳溶液
B.既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C.有手性碳原子
D.1H-NMR谱显示9种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要100mL、1.00mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液冷却到室温后,小心转入A;
③继续加蒸馏水至液面离瓶颈刻度线1~2cm处,改用B小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入仪器A中,并轻轻摇匀;⑤将仪器A塞紧,充分摇匀。
(1)请书写操作②③所使用的仪器:A:____________、B:___________(填仪器名称)
(2)在仪器A上需标记的是___________________________________________
(3)操作步骤正确的顺序是____________________(填序号)。
(4)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为_____________
(5)现用Na2CO3固体配制以上Na2CO3溶液,则需称量Na2CO3___________ g
(6)在配制100mL、0.1mol/L的Na2CO3溶液时,下列操作中的________会导致结果偏低(请用序号填写)。
a.用托盘天平称量时砝码放在左盘
b.将烧杯中的溶液转移到仪器A时不慎洒到仪器A外
c.定容时俯视刻度线
d.定容时仰视刻度线
e.干净的仪器A未经干燥就用于配制溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com