
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
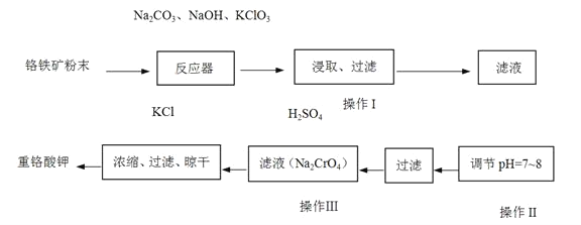
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
【答案】Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑ NaFeO2+ 2H2O=Fe(OH)3↓ + NaOH 除去SiO32-和AlO2- 2CrO42-+2H+
2NaAlO2+CO2↑ NaFeO2+ 2H2O=Fe(OH)3↓ + NaOH 除去SiO32-和AlO2- 2CrO42-+2H+![]() Cr2O72-+H2O Cr2O72-+6I-+14 H+=2Cr3++ 3I2+ 7H2O 94.08%
Cr2O72-+H2O Cr2O72-+6I-+14 H+=2Cr3++ 3I2+ 7H2O 94.08%
【解析】
(1)Al2O3与碳酸钠的反应可以参照玻璃熔炉中SiO2与纯碱的反应,即生成NaAlO2和CO2,化学方程式为:Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(2)NaFeO2的强烈水解即NaFeO2电离的FeO2-离子结合水电离出的H+离子转化为Fe(OH)3沉淀,NaFeO2电离的Na+离子结合水电离出的OH-离子生成NaOH的过程,因此化学方程式为NaFeO2+ 2H2O=Fe(OH)3↓ + NaOH;
(3) 操作Ⅱ是调节pH=7~8,之后是过滤,因此目的是除去Na2CrO4中的杂质离子,由前面的流程中可知,Fe元素已经转化为Fe(OH)3沉淀,因此杂质是Si元素的SiO32-和Al元素的AlO2-;
(4) CrO42-转化为Cr2O72-,由Cr元素的价态都为+6价可知该可逆反应是非氧化还原反应,离子方程式为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(5)重铬酸钾中铬的还原产物为Cr3+,根据化合价的变化,碘化钾中I-被氧化成I2,介质是H2SO4,根据得失电子守恒和电荷守恒,该离子方程式为:Cr2O72-+6I-+14 H+=2Cr3++ 3I2+ 7H2O;依据反应方程式,各物质的量比关系为:Cr2O72-~3I2~6S2O32-,n(S2O32-)=0.1200 mol·L-1×0.040 L=0.0048 mol,推出n(Cr2O72-)=0.0048 mol÷6=0.0008 mol,原试样中的n(Cr2O72-)=0.0008 mol×250mL÷25.00mL=0.008 mol;m(K2Cr2O7)=0.008 mol×294 g/mol=2.352 g;ω(K2Cr2O7)=2.352 g÷2.5000g=94.08%。


科目:高中化学 来源: 题型:
【题目】汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化。
(1)汽车尾气中NO的来源是_________。
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出CO与NO反应的化学方程式:_____________________________。
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是______________
(4)控制或者减少城市汽车尾气污染的方法可以有___________。(多选)
A.开发氢能源 B.使用电动车 C.限制车辆行驶 D.使用乙醇汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B.醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C.在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO42-=BaSO4+2H2O
D.向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.![]() 点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
C.![]() 点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2 ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:

已知:醛或酮与锌汞齐(Zn-Hg)在浓盐酸条件下发生如下反应,称为Clemmensen反应

(1)请举出工业上获得原料A的来源:_________________________________________。
(2)B催化氢化得Z(C10H12O3),写出Z在一定条件下聚合反应的化学方程式:___________。
(3)请写出![]() 的化学方程式:________________,D中官能团名称是____________。
的化学方程式:________________,D中官能团名称是____________。
(4)Clemmensen反应的可能机理是:锌汞齐在浓盐酸的介质中形成原电池,其中锌为__________(填“正极”或“负极”),请写出D在汞电极上生成E的电极反应方程式:____________________。
(5)![]() 的反应类型为_____________。
的反应类型为_____________。
(6)I分子中最多有_______个原子共平面。与I属于同种类型物质且苯环上有两个取代基的同分异构体有_____________种。
(7)符合下列条件的J的一种同分异构体结构简式为______________________。
①属于芳香族化合物,②不能与金属钠反应,③有3种不同化学环境的氢原子。
(8)已知: (R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以
(R表示烃基,R1、R2表示氢或烃基)。请结合题干和已知信息,选用必要的无机试剂,完成以 、
、![]() 为原料制备
为原料制备 的合成路线图。(合成路线流程图示例见本题题干)。
的合成路线图。(合成路线流程图示例见本题题干)。
 _______________
_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某实验小组尝试用燃烧法确定有机物M的分子式,所用装置如下:


①产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是(以上装置不能重复使用):g→fe→hi→ __________ → ___________ →jk。
②F装置作用是________________。
③若准确称取有机物M(只含C、H、O三种元素中的两种或三种)3.24g,经充分燃烧后,A管质量增加9.24g,B管质量增加2.16 g,则该有机物的实验式为________。
④已知在相同条件下该M蒸气相对氢气的密度为54,且能与Na反应但不与NaOH溶液反应,写出该物质在灼热的铜丝条件下与氧气的反应方程式 _________________________________。
(2)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2∶3,试确定该烃的结构简式为________;该烃在光照下生成的一氯代物在核磁共振谱中产生的吸收峰强度比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

(1)用KSCN溶液检验出Fe3+的现象是_______________________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _____________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:

①NaCl溶液的浓度是________ mol·L-1。
②Ⅳ中检测Cl2的实验方法:______________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H <0。请回答下列问题:
2SO3(g) △H <0。请回答下列问题:
(1)某温度下,在一固定体积为2升的密闭容器中,充入2molSO2和lmolO2发生上述反应,当反应进行到2分钟末时达到平衡,平衡混合物中SO3的质量分数为50%,则反应前2分钟内用SO2表示的平均反应速率为_____,SO2的转化率为____,此时反应的平衡常数为_________。
(2)在某恒温、恒压容器中,按体积比2: 1加入SO2和O2进行上述反应,达到平衡后,再向容器中充入适量SO3(g),达到新平衡时,c(O2)将比原平衡_____(填“增大”、“减小”、或“不变”)
(3)若在某恒温、恒容容器中,加入一定量SO3(g)发生上述反应,达到平衡后,再向容器 中充入适量SO3(g),达到新平衡时,c(SO2)/c(SO3)将比原平衡______(填“增大”、“减小”、或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
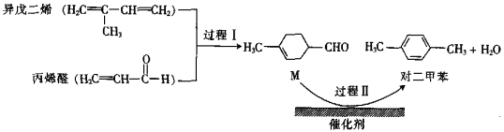
下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com