
【题目】汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化。
(1)汽车尾气中NO的来源是_________。
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出CO与NO反应的化学方程式:_____________________________。
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是______________
(4)控制或者减少城市汽车尾气污染的方法可以有___________。(多选)
A.开发氢能源 B.使用电动车 C.限制车辆行驶 D.使用乙醇汽油
【答案】C 2CO+2NO![]() 2CO2+N2 SO2转化为SO3,产生了硫酸酸雾 ABD
2CO2+N2 SO2转化为SO3,产生了硫酸酸雾 ABD
【解析】
(1)汽车尾气中的NO来源是空气中的N2与O2在汽车气缸内的高温环境或电火花作用下的反应产物,N2+O2![]() 2NO;
2NO;
答案选C;
(2)一氧化碳和一氧化氮在催化剂条件下反应生成可参与大气生态环境的无毒气体二氧化碳和氮气,反应方程式为:2CO+2NO![]() 2CO2+N2;
2CO2+N2;
(3)根据题意知,该催化转换器能促使SO2转化,SO2和氧气发生反应生成SO3,SO3和水蒸气反应生成硫酸,从而产生硫酸酸雾,提高了空气酸度,故答案为SO2转化为SO3,产生了硫酸酸雾;
(4)A.开发氢能源,燃烧产物为水,有利于减少污染,选项A正确;
B.使用电动车有利于减少污染,选项B正确;
C.不能严禁车辆行驶,所以不能通过限制车辆行驶控制污染,选项C错误;
D.使用乙醇汽油,乙醇汽油燃烧生成二氧化碳和水,有利于减少污染,选项D正确;
答案选ABD。


科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚磷酸(H3PO3)为二元弱酸。 H3PO3中P元素的化合价为______,其在元素周期表的位置是__________,H3PO3与过量NaOH溶液反应的离子方程式为___________________。
(2)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示,化合物X可借助傅里叶红外光谱图确定。


①在图示的转化中,被还原的元素是_______________,X的化学式为________________。
②SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A、B两种重要的有机合成原料的结构。下列有关说法中正确的是
A. ![]() B.
B.![]()
A.A与B互为同系物
B.A与B都能与溴的四氯化碳溶液发生加成反应
C.在一定条件下,A与B均能发生取代反应
D.1mol B能与4mol![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② 2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

回答下列问题:
(1)B、D分子中的官能团名称分别是____、_____。
(2)写出下列反应的反应类型:①________,②__________,④_________。
(3)写出下列反应的化学方程式:
①__________;
②__________;
④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s) + 2B(g)![]() C(g) + D(g) 已达到平衡状态‘
C(g) + D(g) 已达到平衡状态‘
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:


为了研究X的结构,将化合物A在一定条件下水解只得到B(结构如图所示)和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应 C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________C______________ E _______________
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)反应①_____________________;反应⑥_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业上重要的氧化剂,实验室利用铬铁矿(主要成份为FeO·Cr2O3)模拟工业生产制备重铬酸钾的主要工艺如下:
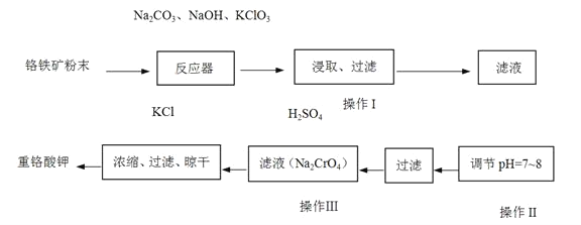
(1) 铬铁矿中的SiO2和Al2O3在反应器中与纯碱共热反应转变为可溶性盐,写出Al2O3与碳酸钠反应的化学方程式:_________。
(2)反应器中发生的主要反应为: 6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O。Fe2O3可进一步转化为NaFeO2。NaFeO2在操作Ⅰ中强烈水解,写出NaFeO2水解的化学方程式:_________。
(3)操作Ⅱ的目的是_________。
(4)操作Ⅰ中CrO42-转化为Cr2O72-,写出此可逆反应的离子方程式:_________
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定至滴定终点时用去Na2S2O3溶液40.00mL(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾与碘化钾反应的离子方程式:_________;
②重铬酸钾试样的纯度(设整个过程中其它杂质不参与反应)为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com