
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
【答案】B
【解析】试题分析::①该反应是反应前后气体体积没有变化的反应,所以容器中的压强不再发生变化,不能证明达到了平衡状态,故①错误;②该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量不变,所以容器内气体的密度不变,当容器中气体的密度不再发生变化时,不能表明达到化学平衡状态,故②不正确;③反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量浓度等不再发生变化,所以B的浓度不再变化时,该反应达到平衡状态,故③正确;④该反应是反应前后气体体积有变化的反应,所以气体总物质的量不变,能表明反应达到平衡状态,故④正确;⑤容器中的气体平均相对分子质量M=m/n,反应前后混合气体的质量不会变化,该反应是一个反应前后物质的量该变的反应,所以当M不再发生变化时,表明已经平衡,故⑤正确;⑥C、D反应速率的比值始终等于化学方程式的系数之比,故⑥错误;⑦总质量始终不变,故错⑧定容容器体积也始终不变,故错⑨生成C、D后,它们的分子数之比始终为1:1,故错


科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
![]()
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到达平衡状态
B. 若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A. 1∶2∶3 B. 3∶1∶1 C. 6∶3∶2 D. 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大.X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨. 请回答下列问题:
(1)元素X的最高价氧化物的电子式为;元素Z的离子结构示意图为 .
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为 . Y、W的氢化物沸点高的是(写化学式),原因是 .
(3)元素W在周期表中的位置 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)F元素名称为_______,在周期表中的位置是_____________。
(2)用电子式表示D与B以1:1的原子个数比形成的化合物的形成过程__________。
(3)化合物BD2中存在的化学键为_____键(填“离子”或“极性”或“非极性”)。A、C、F三种元素形成的化合物CA4F为______化合物(填“离子”或“共价”)。
(4)化合物甲、乙由A、B、D、E中的三种或四种组成。且甲、乙的水溶液均呈碱性,且乙可以用于治疗胃酸过多。则甲、乙反应的离子方程式为____________。
(5)A、C、D、E的原子半径由大到小的顺序是_________(用元素符号表示)。
(6)B的非金属性___于F(填“强”或“弱”),并用化学方程式证明上述结论:_________。
(7)B的最简单氢化物可作为燃料电池的___极,写出熔融碳酸钠介质中负极电极反应式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是a~m九种元素在周期表中的位置,请回答下列问题:
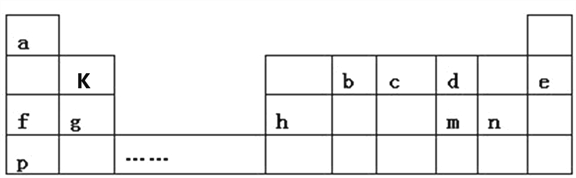
(1)m的阴离子结构示意图为____________。
(2)b的最高价氧化物的电子式为____________;用电子式表示f2 d2的形成过程_______________________。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___________(用离子符号填写)。
(4)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为__________(填化学式)。
(5)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为___________。
(6)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为__________。
(7)k的氧化物与氢氧化钠溶液反应的离子方程式为________________________。
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。

①丁属于_____________(选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是____________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是__________。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。

①则下列有关推断正确的是________________。
A.该反应的化学方程式是:3Z![]() 3X+2Y
3X+2Y
B.t0时,X、Y、Z的质量不再改变
C.t0时,Z的浓度为1.2 mol/L
D.t0时反应停止,反应速率为0
②t0时,Z的转化率为_____________。
③若t0=2min,则2min内用Y的浓度变化表示的反应速率为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com