
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
![]()
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到达平衡状态
B. 若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
【答案】B
【解析】试题分析:A.CrO42﹣为黄色的,Cr2O72﹣为橙色的,如果2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)未达到平衡,正向进行,则橙色加深,如果逆向进行则黄色加深。现在溶液颜色保持不变,说明上述可逆反应达到达平衡状态。正确。B. 在1L废水中+6价的Cr的物质的量为n(Cr)=" 28.6g÷" 52g/mol ="0.55mol" .根据氧化还原反应中电子得失数目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.错误。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq)
Cr2O72﹣(aq)+H2O(1)未达到平衡,正向进行,则橙色加深,如果逆向进行则黄色加深。现在溶液颜色保持不变,说明上述可逆反应达到达平衡状态。正确。B. 在1L废水中+6价的Cr的物质的量为n(Cr)=" 28.6g÷" 52g/mol ="0.55mol" .根据氧化还原反应中电子得失数目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.错误。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)的平衡常数为
Cr2O72﹣(aq)+H2O(1)的平衡常数为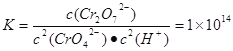 c(CrO42-)="{(28.6÷52)÷11}mol/L=0.05mol/L," c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入该平衡常数表达式中可得c(H+)=10-6mol/L.所以pH=6.正确。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正确.
c(CrO42-)="{(28.6÷52)÷11}mol/L=0.05mol/L," c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入该平衡常数表达式中可得c(H+)=10-6mol/L.所以pH=6.正确。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正确.


科目:高中化学 来源: 题型:
【题目】《本草纲目》中“烧酒”条目为:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.蒸馏B.萃取C.过滤D.升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率____________;
(2)为了提高生成SO2的速率,可以采取的措施是______________;
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
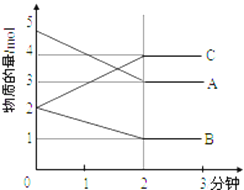
(3)该反应的化学方程式为_________________;
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是_______________
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+ CO2(g)==Na2CO3(s)+1/202(g) △H=-226kJ/mol
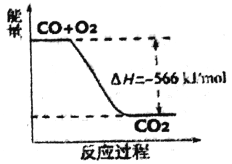
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283kJ
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(g)==2Na2CO3(s)+ 02(g) △H<-452kJ/mol
D. CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数约为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸常用于金属表面除锈.(原理:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O)
(1)把50g质量分数为98%的浓硫酸,稀释成10%的稀硫酸,需要水的质量是多少?
(2)要使16gFe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
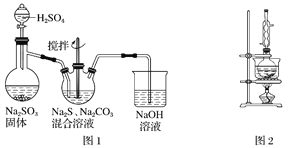
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是________________________。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除生成Na2S2O3外,还有________(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:_______________________________________________________________________。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加________作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有________。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤如下,请填写实验操作。
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示组装所需仪器,向冷凝管中通入冷却水,水浴加热;
③待________________时,停止加热,将烧瓶取下;
④____________________________________________________________________;
⑤____________________________________________________________________;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com