
【题目】已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+ CO2(g)==Na2CO3(s)+1/202(g) △H=-226kJ/mol
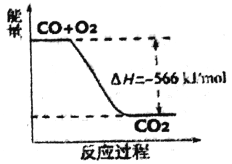
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283kJ
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(g)==2Na2CO3(s)+ 02(g) △H<-452kJ/mol
D. CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数约为2×6.02×1023
【答案】D
【解析】A.CO的燃烧热应该为283kJ/mol,A错误;B.该图描述的就是一个热化学方程式,所以对应566数值的应该是2CO(g)+O2(g)=2CO2,B错误;C.题目中第二个方程的2倍为:2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,C错误;D.已知:① 2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,② Na2O2(s)+CO2(g)==Na2CO3(s)+1/202(g)△H=-226kJ/mol,根据盖斯定律(①+②×2)/2即得到Na2O2(s)+CO(g)=Na2CO3(s)△H=-509 kJ/mol,此时放热509kJ,因为CO是1mol,所以转移电子数是2倍的6.02×1023,D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝不易发生化学反应
D.铝易氧化,形成的氧化膜有保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定对人类的生存发展具有重要意义,科学家一直致力于“人工固氮”的新方法研究。
(1)豆科植物的根瘤菌含有一种固氮酶,能在常温下将空气中的氮气转化为自身生长所需的含氮化合物,下列说法错误的是____(填标号)。
a.固氮酶是一种蛋白质
b.固氮酶能降低固氮反应发生所需的能量
c.固氮酶能使固氮反应的平衡正向移动
d.固氮酶能加快固氮反应的速率
(2)合成氨是目前最重要的固氮方法。下图为合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
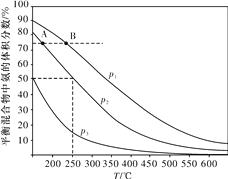
①A、B两平衡状态相比较,前者较大的是____(填标号)。
a.平衡常数
b.平衡混合物的平均摩尔质量
c.氢气的转化率
d.从反应开始至达到平衡状态所需要的时间
②图中p1、p2、p3由大到小的顺序为____。
③在250 ℃、p2下,H2的转化率为____%(结果保留小数点后一位)。
(3)据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和一种单质。已知:
①H2(g)+![]() O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.2 kJ/mol
2NH3(g) ΔH2=-92.2 kJ/mol
写出此条件下氮气和水反应的热化学方程式:___。
(4)下图为一种常温常压下水溶液中电化学合成氨的实验装置示意图。请据此写出其正极反应的电极反应式:__。
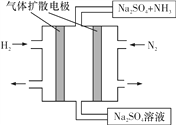
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵可用作火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度见下图),其实验流程如下:
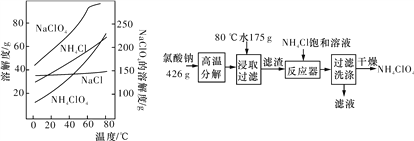
(1)氯酸钠高温分解生成高氯酸钠和氯化钠的化学方程式为____。
(2)80 ℃时浸取液冷却至0 ℃过滤,滤渣的主要成分为___(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为___。
(4)已知:2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O。现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O。现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵受热分解产生的三种气体分别进行吸收或收集。
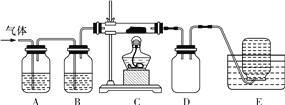
①E中收集到的气体可能是____(填化学式);
②A、B、C中盛放的药品依次可以是___(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
Ⅰ.a、b、c Ⅱ.c、b、e Ⅲ.b、c、f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
![]()
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到达平衡状态
B. 若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质X和Y相互反应生成X2+和Y2-,现有下列叙述其中正确的是( )
①X被氧化 ②X是氧化剂 ③X具有氧化性
④Y2-是还原产物 ⑤Y2-具有还原性 ⑥X2+具有氧化性
A.①②③④B.①④⑤⑥C.②③④D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大.X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨. 请回答下列问题:
(1)元素X的最高价氧化物的电子式为;元素Z的离子结构示意图为 .
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为 . Y、W的氢化物沸点高的是(写化学式),原因是 .
(3)元素W在周期表中的位置 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com