
【题目】《本草纲目》中“烧酒”条目为:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.蒸馏B.萃取C.过滤D.升华
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵. 已知盐的热分解温度:NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3>850℃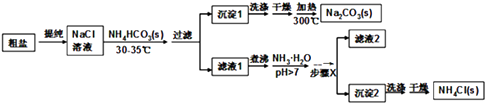
(1)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3 , 其加入的顺序合理的是 A.①③④②B.①②④③C.③②④①D.①②③④
过滤中用到玻璃棒的作用是;
(2)如何判断粗盐中SO42﹣是否已除尽?;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是;
(4)写出沉淀1受热分解的化学方程式;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是;步骤X包括的操作有;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液.从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL.则该样品中氯化铵的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1molN2和xmolH2发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。经过5min达到平衡时,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。试回答(请书写必要的计算步骤):
2NH3(g)。经过5min达到平衡时,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。试回答(请书写必要的计算步骤):
(1)起始时充入H2的物质的量_________;
(2)平衡时N2的浓度_______;
(3)5min内用NH3表示的化学反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝不易发生化学反应
D.铝易氧化,形成的氧化膜有保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和1.01×105Pa时,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中碳循环(如图)的说法中,不正确的是( ) 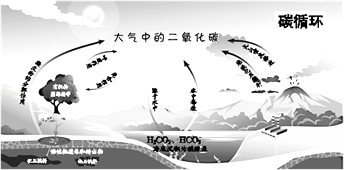
A.呼吸作用涉及氧化还原反应
B.碳循环具有全球性
C.含碳化合物可相互转化
D.碳元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-Q kJ/mol(Q>0)。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,上述三个过程对应的能量变化值分别为Q1、Q2、Q3。下列说法正确的是
CO2(g)+H2(g) ΔH=-Q kJ/mol(Q>0)。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,上述三个过程对应的能量变化值分别为Q1、Q2、Q3。下列说法正确的是
A. 2Q1=2Q2<Q3
B. 容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量高
C. 容器Ⅰ中反应的平衡常数比容器Ⅱ中反应的平衡常数小
D. 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
![]()
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到达平衡状态
B. 若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com