
����Ŀ��ij�о�С���Դ��κ�̼����泥�NH4HCO3��Ϊԭ�ϣ��������������Ʊ�������Ȼ�泥� ��֪�ε��ȷֽ��¶ȣ�NH4HCO3 36�棻 NaHCO3 270�棻 NH4Cl 340�棻 Na2CO3��850��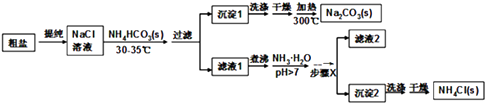
��1�������к���Ca2+��Mg2+��SO42�����������ӣ�ʹ�õ��Լ��У���NaOH ��BaCl2��HCl ��Na2CO3 �� ������˳��������� A���٢ۢܢ�B���٢ڢܢ�C���ۢڢܢ�D���٢ڢۢ�
�������õ�����������������
��2������жϴ�����SO42���Ƿ��ѳ�������
��3����NaCl��Һ������1�Ĺ����У�������Ũ�����ڼ������NH4HCO3֮ǰ��������Ũ�������ڼ���NH4HCO3֮��ԭ������
��4��д������1���ȷֽ�Ļ�ѧ����ʽ��
��5��Ϊ���NH4Cl��Ʒ�IJ��ʺʹ��ȣ�������Һ�м��백ˮ��������������X�����IJ�������
��6�����á���ȩ�����ⶨ��ҵ��Ʒ���Ȼ�淋Ĵ��ȣ��ٶ����ʲ����ȩ��Ӧ������Ӧԭ��Ϊ��4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O ij������Ա��ȡ1.5g����Ʒ����ˮ�����������ļ�ȩ����ˮ���100mL��Һ������ȡ��10mL�������̪����0.1mol/L��NaOH��Һ�ζ������ζ��յ�ʱ����NaOH��Һ25.00mL�������Ʒ���Ȼ�淋���������Ϊ ��
���𰸡�
��1��B������
��2��ȡ�������Ӻ����Ʒ���Թ��У��μ������Ȼ�����Һ�����ް�ɫ������������SO42���ѳ���
��3���ɱ���NH4HCO3�ķֽ�
��4��2NaHCO3 ![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��5������NH4+ˮ�⣻ʹNaHCO3ת��ΪNa2CO3���������ʱ��ʧ��NH3����Ũ������ȴ�ᾧ������
��6��89.2%
���������⣺��1�������к���Ca2+��Na2CO3��ȥ��Mg2+��NaOH��ȥ��SO42����BaCl2��ȥ�����ǵ���SO42��ʱ���μӹ�����BaCl2 �� �����Ba2+Ҳ��Ҫ��Na2CO3��Һ��ȥ������ȷ�IJ���˳��Ϊ�ȵμӹ���NaOH��Һ���ٵμӹ���BaCl2��Һ��Ȼ��μӹ���Na2CO3��Һ�����˺������Һ��μ�ϡ�����ữ��ѡ��B�������⣻���˲�����ʹ�ò��������������ã��ʴ�Ϊ��B����������2���жϴ�����SO42���Ƿ��ѳ�����ʵ�ʼ���SO42���Ƿ���ڣ���ѡ��BaCl2��Һ�����飬��������ǣ�ȡ�������Ӻ����Ʒ���Թ��У��μ������Ȼ�����Һ�����ް�ɫ������������SO42���ѳ������ʴ�Ϊ��ȡ�������Ӻ����Ʒ���Թ��У��μ������Ȼ�����Һ�����ް�ɫ������������SO42���ѳ�������3��NH4HCO3�ܲ��ȶ������ֽ⣬�ڼ�NH4HCO3ǰ����Ũ��NaCl��Һ���ɱ���NH4HCO3�ķֽ⣬�ʴ�Ϊ���ɱ���NH4HCO3�ķֽ⣻��4������1��NaHCO3 �� �����ȷֽ�ķ���ʽΪ��2NaHCO3 ![]() Na2CO3+H2O+CO2���� �ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2���� �ʴ�Ϊ��2NaHCO3 ![]() Na2CO3+H2O+CO2������5��NH4Cl��ǿ����������ˮ�⣬��ˮ�����ɵ�HCl�лӷ��ԣ�NH3H2O���ȶ����ֽ�ų�NH3 �� �ʼ��ȹ��������Ӱ�ˮ��������ˮ�⣬����ӷ��İ������������NH4Cl�IJ��ʺʹ��ȣ�����X�IJ���Ŀ���Ǵ���Һ������NH4Cl���壬��������Ũ������ȴ�ᾧ�����ˣ�Ϊ���NH4Cl��Ʒ�IJ��ʺʹ��ȣ�������Һ�м��백ˮ�������ǣ�����NH4+ˮ�⣻ʹNaHCO3ת��ΪNa2CO3 �� ����X�����IJ����У��������ʱ��ʧ��NH3����Ũ������ȴ�ᾧ�����ˣ��ʴ�Ϊ������NH4+ˮ�⣻ʹNaHCO3ת��ΪNa2CO3���������ʱ��ʧ��NH3����Ũ������ȴ�ᾧ�����ˣ���6�����á���ȩ�����ⶨ��ҵ��Ʒ���Ȼ�淋Ĵ�����ԭ����4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O������NaOH��Һ�ζ�������ԭ���غ���ɿɵù�ϵʽ��NH4Cl��HCl��NaOH����֪�ζ�ʱ����NaOH�����ʵ�������ԭ��Ʒ��NH4Cl�����ʵ�����10mL��Һ����NaOH�����ʵ���Ϊ0.1mol/L��0.025L=0.00025mol������Ʒ��NH4Cl�����ʵ���Ϊ0.00025mol��10=0.025mol������Ϊ0.025mol��53.5gmol��1=1.3375g������Ʒ���Ȼ�淋���������=
Na2CO3+H2O+CO2������5��NH4Cl��ǿ����������ˮ�⣬��ˮ�����ɵ�HCl�лӷ��ԣ�NH3H2O���ȶ����ֽ�ų�NH3 �� �ʼ��ȹ��������Ӱ�ˮ��������ˮ�⣬����ӷ��İ������������NH4Cl�IJ��ʺʹ��ȣ�����X�IJ���Ŀ���Ǵ���Һ������NH4Cl���壬��������Ũ������ȴ�ᾧ�����ˣ�Ϊ���NH4Cl��Ʒ�IJ��ʺʹ��ȣ�������Һ�м��백ˮ�������ǣ�����NH4+ˮ�⣻ʹNaHCO3ת��ΪNa2CO3 �� ����X�����IJ����У��������ʱ��ʧ��NH3����Ũ������ȴ�ᾧ�����ˣ��ʴ�Ϊ������NH4+ˮ�⣻ʹNaHCO3ת��ΪNa2CO3���������ʱ��ʧ��NH3����Ũ������ȴ�ᾧ�����ˣ���6�����á���ȩ�����ⶨ��ҵ��Ʒ���Ȼ�淋Ĵ�����ԭ����4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O������NaOH��Һ�ζ�������ԭ���غ���ɿɵù�ϵʽ��NH4Cl��HCl��NaOH����֪�ζ�ʱ����NaOH�����ʵ�������ԭ��Ʒ��NH4Cl�����ʵ�����10mL��Һ����NaOH�����ʵ���Ϊ0.1mol/L��0.025L=0.00025mol������Ʒ��NH4Cl�����ʵ���Ϊ0.00025mol��10=0.025mol������Ϊ0.025mol��53.5gmol��1=1.3375g������Ʒ���Ȼ�淋���������= ![]() ��100%=89.2%���ʴ�Ϊ��89.2%��
��100%=89.2%���ʴ�Ϊ��89.2%��
�����������̿�֪������ˮ�ᴿ����Ȼ�����Һ��������Ũ�����¶ȿ�����30�桫35�棬��ֹ̼���ⰴ�ֽ⣬����̼����泥����ɳ���1Ϊ̼�����ƣ���Һ1��ҪΪ�Ȼ�泥��Ȼ����Һ�м��백ˮ��������笠����ӵ�ˮ�⣬��������Ũ������ȴ�ᾧ�����˿ɵó���2Ϊ�Ȼ�粒��壬��ϴ�ӡ�����ô������Ȼ�泥���Һ2�к����������Ȼ�狀�̼�����ƣ���1�������к���Ca2+��Mg2+��SO42�����������ӣ�ʹ�õ��Լ��У���NaOH ��BaCl2��HCl ��Na2CO3 �� ����ǰ�����������ǹ����ģ��ں������������ڳ�ȥ��Һ��ԭ���������Ҫ��ǰ�������Լ����ʳ�ȥ���ݴ��жϣ��������õ�����������������������2����Ʒ�м����������Ȼ�����Һ���жϴ�����SO42���Ƿ��ѳ�������3������Ũ��ʱ��ҺҪ���ȣ���NH4HCO3��36�濪ʼ�ֽ⣬�ݴ˴��⣻��4��̼���������ȷֽ�����̼���ơ�������̼��ˮ����5����ˮ������笠����ӵ�ˮ�⣬ͬʱ��ʹNaHCO3ת��ΪNa2CO3 �� ���������ʱ��ʧ��NH3 �� ���Ȼ����Һ�õ��Ȼ�粒������ͨ������Ũ������ȴ�ᾧ�����˵ķ�������6���ɵζ���ȥ���������Ƶ����ʵ����������������ʵ��������ݷ���ʽ4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O��������Ȼ�淋������������������Ʒ���Ȼ�淋�����������


 �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Ħ���棬���ӽṹ��ͼ��ʾ�������й���������˵����ȷ���ǣ� ��
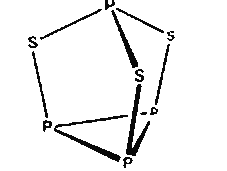
A. ����������Ԫ�صĻ��ϼ�Ϊ+3
B. 22 g P4S3����ԭ����ĿԼΪ1.806��1023
C. �����ʷ��ӽṹ��S��P��������������Ϊ8
D. �����ʷ�����ȫ�Ǽ��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ�صIJ�����Ϣ���±���ʾ��
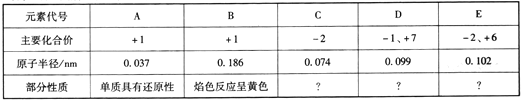
��1��E��Ԫ�����ڱ��е�λ����____________________��
��2����BDC��Һ�еμӷ�̪��Һ����Һ�ȱ�����ɫ��ԭ����__________________(�����ӷ���ʽ��ʾ)��
��3��25��ʱ��pH��Ϊ10��BCA��Һ��B2E��Һ�У�ˮ�������c(OH-)֮��Ϊ____________��
��4��������ʵ�У���˵��D�ķǽ����Ա�Eǿ����________ (����ĸ)��
a��D�ļ��⻯���E���ȶ� b��AD�����Ա�A2E��ǿ
c��D�ĵ��ʵķе����E�ĵ��� d��D2��A2E�ܷ����û���Ӧ
��5��500��ʱ�����ݻ�Ϊ1L�ĺ����ܱ������г���2mol EC3���壬�ڴ��������·�����Ӧ������10minǡ�ôﵽƽ�⣬���ƽ��Ũ��c(C2)=0.75mol��L-1��
�ٷ�Ӧ�ӿ�ʼ��ƽ��ʱ��ƽ����Ӧ����v(EC2)=____________��
��EC3��ƽ��ת����Ϊ____________��
�������������䣬���������г�������EC3���壬��EC3��ƽ��ת���ʻ�________ (�������С�����䡱)��
��6����B2E2C3��Һ�еμ�BAEC4��Һ����������ɫ�������ݳ��̼������壬��Ӧ�����ӷ���ʽΪ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��̽����������ø����ø�ٷ�Ӧ����Ӱ���ʵ��װ��ͼ����ش��������⣺
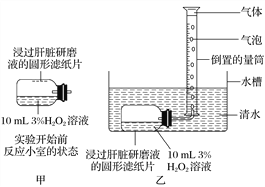
(1)��ʵ���ж��Ա����Ŀ��ƿ�ͨ��________________________��ʵ�֡������Ա�����������⣬��ʵ�����ر�����(�����Ҫ����)__________________��
(2)��Ҫ��֤ø��רһ�ԣ��ڴ�ʵ��װ�õĻ����ϣ�Ӧ��θĽ�(��д������Ĵ�ʩ)��
______________________________________________________________��
(3)�ܷ��ñ�ʵ��װ������֤�¶ȶ�ø���Ե�Ӱ�죿____________��ԭ����__________________________��
(4)�ڹ���������Һ��ͬŨ�ȡ���ͬ����IJ�ͬʵ�����м����С��ͬ��ͬ��Ŀ�Ľ���������ĥҺ����ֽƬ����ʵ�����������ɵ��������Ƿ���ͬ__________��ԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijŨ���ص�ԭ��ʾ����ͼ��ʾ���õ�ش�Ũ����ˮ����ȡLiCl��ͬʱ�ֻ���˵��ܡ������йظõ�ص�˵����ȷ����

A. ������X��ͨ�����·����Y�� B. ��ع���ʱ��Li+ͨ�����ӵ�������Ǩ��
C. ���������ķ�ӦΪ:2H++2e-=H2�� D. Y��ÿ����1molCl2�����·��ͨ��2mole-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ����~�������ڱ��е�λ�������ʾ���Իش��������⡣
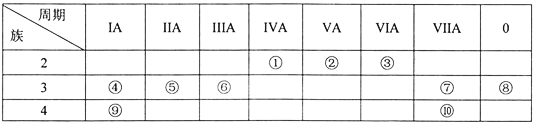
��1������10��Ԫ���У���ѧ��������õ���___(��Ԫ�ط��ţ���ͬ)����ˮ��Ӧ��ҵĽ���Ԫ����___________��
��2��Ԫ��������̬�⻯��ķ���ʽ��_____������10��Ԫ���У�������������Ӧˮ�����������ǿ��������_______(�ѧʽ)��
��3��Ԫ���������γɵij������������Ļ�����ĵ���ʽ_________��
��4���٢ڢ�Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ______(��Ԫ�ط��ű�ʾ)��
����һ����ѧ����ʽ(�����ӷ���ʽ)˵��Ԫ���������ǽ����Ե�ǿ����_____��
��5����������Ԫ�ص�����������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����̬������һ����̬ϩ����ɵĻ�����干10g�����ܶ�����ͬ������H2��12.5�����û����ͨ��Br2ˮʱ��Br2ˮ����8.4g������ɸû�����Ŀ����ǣ� ��
A.���顢��ϩ
B.���顢��ϩ
C.���顢��ϩ
D.���顢��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ݸ�Ŀ�������վ�����ĿΪ������Ԫʱʼ���䷨����Ũ�ƺ�����굣��������ϡ���������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ
A.����B.��ȡC.����D.����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com