
【题目】某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法正确的是

A. 电子由X极通过外电路移向Y极 B. 电池工作时,Li+通过离子导体向右迁移
C. 负极发生的反应为:2H++2e-=H2↑ D. Y极每生成1molCl2,外电路中通过2mole-
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】向体积和物质的量浓度都相等的盐酸和氢氧化钠溶液中投入足量的铝粉,放出的氢气在同温同压下的体积之比为
A. 1︰1 B. 1︰3 C. 3︰1 D. 1︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.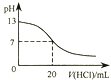
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.
图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C.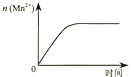
图③表示10 mL 0.01 molL﹣1 KMnO4 酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.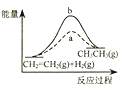
图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B和C为短周期元素,原子序数依次减小,A的最低负化合价为﹣2,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等.回答下列问题:
(1)A、B和C分别为、、(用元素名称表示).
(2)由以上元素组成的化合物中,属于离子化合物的是 , 属于共价化合物的是 . (各写一种即可)
(3)B的常见气态氢化物的电子式为 , B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有(填化学键的种类),该离子氯化物的水溶液呈性,用离子方程式表示为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵. 已知盐的热分解温度:NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3>850℃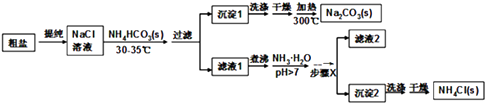
(1)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3 , 其加入的顺序合理的是 A.①③④②B.①②④③C.③②④①D.①②③④
过滤中用到玻璃棒的作用是;
(2)如何判断粗盐中SO42﹣是否已除尽?;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是;
(4)写出沉淀1受热分解的化学方程式;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是;步骤X包括的操作有;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液.从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL.则该样品中氯化铵的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学品要在包装标签上印有警示性标志。下列化学药品名称与警示标志名称对应正确的是( )
A.浓硫酸——腐蚀品B.酒精——剧毒品
C.汽油——爆炸品D.烧碱——剧毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各电离方程式中,书写正确的是( )
A.H2S2H++S2﹣
B.KHSO4K++H++SO42﹣
C.Al(OH)3Al3++3OH﹣
D.HClO═H++ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中碳循环(如图)的说法中,不正确的是( ) 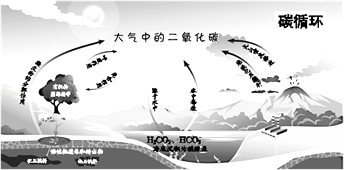
A.呼吸作用涉及氧化还原反应
B.碳循环具有全球性
C.含碳化合物可相互转化
D.碳元素均被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com