
【题目】向体积和物质的量浓度都相等的盐酸和氢氧化钠溶液中投入足量的铝粉,放出的氢气在同温同压下的体积之比为
A. 1︰1 B. 1︰3 C. 3︰1 D. 1︰2
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪个氧化性更强? 猜想:①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致.
(2)设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的. 供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到得现象.
选用试剂(填序号) | 实验现象 | |
方案1 | ||
方案2 |
(3)结论 氧化性:Br2>Fe3+ . 故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 .
(4)实验后的思考 ①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 .
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有 ![]() 的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷的说法正确的是( )
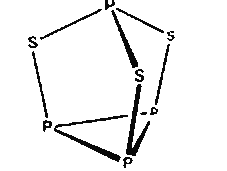
A. 该物质中磷元素的化合价为+3
B. 22 g P4S3含硫原子数目约为1.806×1023
C. 该物质分子结构中S、P最外层电子数均不为8
D. 该物质分子中全是极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA
B.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣数目为0.2NA
C.标准状况下,22.4LCHCl3含有的分子数为NA
D.1L 0.1molL﹣1的硫化钠溶液中硫离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法正确的是

A. 电子由X极通过外电路移向Y极 B. 电池工作时,Li+通过离子导体向右迁移
C. 负极发生的反应为:2H++2e-=H2↑ D. Y极每生成1molCl2,外电路中通过2mole-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com