
【题目】摩尔是表示( )
A.物质的量的单位B.物质的量的浓度
C.物质的质量的单位D.微粒个数的单位
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】字母A﹣F代表六种不同物质,它们之间可发生如图的转化(部分反应中生成物没有全部列出).其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧.分析图示回答下列问题: 
(1)A可以是或;
(2)E在CO2中燃烧的化学方程式为;
(3)D与F反应的化学方程式为 , 该反应中D表现了性;
(4)50mL 14molL﹣1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为mol,参加反应的铜的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgSO4,含有少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)为加快酸溶速率,可采取的办法有______,写出酸溶时废渣中主要成分发生反应的化学方程式为_________________。
(2)加入H2O2氧化时发生发应的离子方程式为_________________。
(3)用萃取分液的方法除去溶液中的Fe3+。
①检验溶液中是否含有Fe3+的最佳试剂是_________________。
②为使Fe3+ 尽可能多地从水相转移至有机相,采取的操作:向水溶液中加入一定量的萃取剂,_______、静置、分液,并重复多次。
③萃取时,向混合溶液(含Fe2+、Al3+、Mg2+)中加入适量盐酸,使Fe2+ 与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-。该缔合物中,Cl-和Et2O分别取代了Fe2+和H+的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,就从水相转移到有机相中。该萃取剂不能萃取Al3+、Mg2+的原因是_________。
(4)已知:Ksp[Al(OH)3]=1.0×10-33,Ksp[(Mg(OH)2)=1.0×10-12.pH=8.5时Mg(OH)2开始沉淀。室温下,除去MgSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需加入氨水调节溶液pH的范围为____________。
(5)向滤液中加入Na2CO3溶液生成MgCO3 沉淀并用蒸馏水洗涤,检验沉淀是否洗净的操作是________________。
(6)干燥时需低温干燥,温度较高时发生副反应,写出MgCO3·3H2O在323K温度时发生转化的化学方程式________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
A. 密闭容器中氨气的体积分数不变
B. 1mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 2v(NH3)=v(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A.乙醇不能发生取代反应
B.C4H10有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积和物质的量浓度都相等的盐酸和氢氧化钠溶液中投入足量的铝粉,放出的氢气在同温同压下的体积之比为
A. 1︰1 B. 1︰3 C. 3︰1 D. 1︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.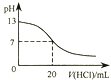
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.
图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C.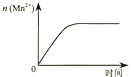
图③表示10 mL 0.01 molL﹣1 KMnO4 酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.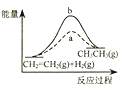
图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com