
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgSO4,含有少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)为加快酸溶速率,可采取的办法有______,写出酸溶时废渣中主要成分发生反应的化学方程式为_________________。
(2)加入H2O2氧化时发生发应的离子方程式为_________________。
(3)用萃取分液的方法除去溶液中的Fe3+。
①检验溶液中是否含有Fe3+的最佳试剂是_________________。
②为使Fe3+ 尽可能多地从水相转移至有机相,采取的操作:向水溶液中加入一定量的萃取剂,_______、静置、分液,并重复多次。
③萃取时,向混合溶液(含Fe2+、Al3+、Mg2+)中加入适量盐酸,使Fe2+ 与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-。该缔合物中,Cl-和Et2O分别取代了Fe2+和H+的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,就从水相转移到有机相中。该萃取剂不能萃取Al3+、Mg2+的原因是_________。
(4)已知:Ksp[Al(OH)3]=1.0×10-33,Ksp[(Mg(OH)2)=1.0×10-12.pH=8.5时Mg(OH)2开始沉淀。室温下,除去MgSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需加入氨水调节溶液pH的范围为____________。
(5)向滤液中加入Na2CO3溶液生成MgCO3 沉淀并用蒸馏水洗涤,检验沉淀是否洗净的操作是________________。
(6)干燥时需低温干燥,温度较高时发生副反应,写出MgCO3·3H2O在323K温度时发生转化的化学方程式________________。

【答案】 适当升高温度、搅拌、提高硫酸浓度(答案合理即给分) MgCO3+H2SO4=MgSO4+H2O+CO2↑ H2O2+2Fe2++2H+=2Fe3++2H2O KSCN溶液 充分振荡 A13+、Mg2+与Cl-结合(生成配离子)的能力很弱 5.0-8.5 取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉定,则表明已选涤完全。 5MgCO3·3H2O![]() Mg5(OH)2(CO3)4·4H2O+CO2↑+10H2O
Mg5(OH)2(CO3)4·4H2O+CO2↑+10H2O
【解析】(1) 适当升高温度、用工具搅拌、提高硫酸浓度等都可以加快酸溶速率;酸溶时废渣中的MgCO3、少量Fe、Al的氧化物都能被酸溶解,其中主要的反应的化学方程式为MgCO3+H2SO4=MgSO4+H2O+CO2↑,故答案为:MgCO3+H2SO4=MgSO4+H2O+CO2↑;
(2)加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)①检验溶液中是否含有Fe3+的最佳方法是加入KSCN溶液,若溶液变成红色,说明含有Fe3+,故答案为:KSCN溶液;
②萃取时,为使溶质尽可能被萃取,应充分振荡,以充分接触而分离,故答案为:充分振荡;
③根据题意,Fe2+与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-,能够溶于乙醚中。因此,就从水相转移到有机相中。而A13+、Mg2+与Cl-结合(生成配离子)的能力很弱,Al3+、Mg2+仍然留在水相中,故答案为:A13+、Mg2+与Cl-结合(生成配离子)的能力很弱;
(4)pH=8.5时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6molL-1,解得:c(OH-)=1×10-9molL-1,c(H+)=1×10-5molL-1pH=5,同理Fe(OH)3完全变成沉淀时,pH约为3.5,故pH范围是:5.0<pH<8.5,故答案为:5.0<pH<8.5;
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,检验沉淀是否洗净只需要具有洗涤液中是否存在SO42-即可,具体方法为取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉定,则表明已选涤完全,故答案为:取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉定,则表明已选涤完全;
(6)MgCO33H2O在323K温度时转化成Mg5(OH)2(CO3)44H2O,反应的化学方程式为5MgCO33H2O![]() Mg5(OH)2(CO3)44H2O+CO2↑+10H2O,故答案为:5MgCO33H2O
Mg5(OH)2(CO3)44H2O+CO2↑+10H2O,故答案为:5MgCO33H2O![]() Mg5(OH)2(CO3)44H2O+CO2↑+10H2O。
Mg5(OH)2(CO3)44H2O+CO2↑+10H2O。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 铅蓄电池放电时铅电极发生还原反应
B. 钢铁吸氧腐蚀的正极反应:O2+2e-+2H2O=4OH-
C. 给铁钉镀铜可采用Cu2+作电镀液
D. 生铁浸泡在食盐水中发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃的混合物共1L,在空气中完全燃烧得到1.5L CO2和2L水蒸气(体积均在同温同压下测定),关于此混合烃的判断正确的是( )
A.肯定是甲烷和乙烯的混合物
B.一定不是甲烷和乙烯的混合物
C.一定含乙烯,不含甲烷
D.两种烃分子中氢原子数都是4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
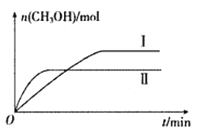
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼一般有下列四种方法:①焦炭法 ②水煤气(或H2、CO)法 ③活泼金属置换法④电解法.这四种方法在工业上均有应用.古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜.现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁.对它们的冶炼方法的分析,不正确的是( )
A.(Ⅰ),①
B.(Ⅱ),②
C.(Ⅲ),③
D.(Ⅳ),④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | ||||||||||||||
L | M | O |
(1)元素L的价电子排布图为__________,元素M的原子结构示意图为________,位于元素周期表五个区域中的_______区。上述元素中电负性最强的是_______(用元素符号表示),C、D、E、F第一电离能的大小顺序为____________(用元素符号表示)。
(2)D的氢化物和J氢化物沸点较高的是______(填化学式),稳定性更强的是______(填化学式)。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素I与元素B的单质有相似的性质。写出元素单质B与NaOH溶液反应的离子方程式___________________________。
(4)A、E、H、J四种元素的原子半径由大到小的排列顺序为___________________;E、F、H、K四种元素简单离子的半径由大到小的排列顺序为________________用元素符号表示)。
(5)能证明元素K比元素J的非金属性强的事实是______________(填序号)。
A.常温下K单质的密度小于J单质的密度
B.K元素的气态氢化物比J元素的气态氢化物更稳定
C.K单质与氢气反应的程度比J单质与氢气反应的程度更剧烈
D.K元素的氧化物对应的水化物酸性强于J元素的氧化物对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是
A. 青菜中含有维生素C
B. 维生素C具有还原性
C. 致人中毒过程中砷发生还原反应
D. 砒霜是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中对利用K2CO3 去油污有如下叙述:“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱烷衣。”文中涉及的化学反应属于( )
A. 水解反应 B. 置换反应 C. 醋化反应 D. 加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com