
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
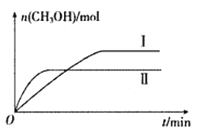
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

【答案】 -159.47 高温 BD 否 > 12.5% 0.4<c<1 300~400℃
【解析】(1)①反应Ⅰ:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=a kJmol-1,反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+H2O(g)△H2=+72.49kJmol-1,总反应Ⅲ:2NH3(g)+CO2(g) =CO(NH2)2(s)+H2O(g)△H3=-86.98kJmol-1,由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=a=-159.47kJmol-1,故答案为:-159.47;
②反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+H2O(g)△H2=+72.49kJmol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:高温;
③A.反应I中反应物为气体,生成全部为固体,所以在反应前后,混合气体的平均相对分子质量保持不变,所以不能作为平衡状态的判断标志,故A错误;B.反应I中,气体的物质的量减小,所以反应的压强减小,所以容器内气体总压强不再变化时,说明反应处于平衡状态,故B正确;C.反应处于平衡状态时v正(NH3)=2v逆(CO2),故C错误;D.反应I中,容器体积不变,气体质量减小,所以当容器内混合气体的密度不再变化时,说明反应处于平衡状态,故D正确;故选BD;
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,发生NH2CO2NH4(s) ![]() CO(NH2)2(s)+H2O(g),水蒸气进入环境中,浓度近似为0,无论经过多长时间,反应都不会建立平衡状态,故答案为:否;
CO(NH2)2(s)+H2O(g),水蒸气进入环境中,浓度近似为0,无论经过多长时间,反应都不会建立平衡状态,故答案为:否;
(2)①II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,,故答案为:>;
②设二氧化碳反应量为x
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始量(mol): 1 3 0 0
转化量(mol): x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即![]() =0.8 ,解得x=0.4mol,甲容器平衡混合气体中CH3OH(g)的体积分数=物质的量分数=
=0.8 ,解得x=0.4mol,甲容器平衡混合气体中CH3OH(g)的体积分数=物质的量分数=![]() ×100%=12.5%;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<c<1mol,故答案为:12.5%;0.4<c<1;
×100%=12.5%;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<c<1mol,故答案为:12.5%;0.4<c<1;
(3)①温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,故以后乙酸的生成速率升高是由温度升高导致的,故乙酸主要取决于温度影响的范围为300℃~400℃,故答案为:300℃~400℃。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】纠错题
(1)有机物命名要规范,熟悉系统命名法。请指出下列命名中的错误,并订正。
①(CH3)2CHC≡CH:3,甲基1,丁炔或2甲基3丁炔 订正________________________。
②CH2Cl—CH2Cl:二氯乙烷 订正________________________________。
(2)化学式、键线式、结构式、结构简式等不能混同。请订正下面的错误。
①乙醇的化学式为CH3CH2OH 订正________________________________。
②1,4二溴2丁烯的键线式:BrCH2CH===CHCH2Br 订正________________________。
(3)官能团、取代基及原子间的连接方式要正确,官能团写在左边时要特别注意。请订正下面的错误。
①对苯二酚![]() 订正_______________________________________。
订正_______________________________________。
②聚丙烯:![]() 订正________________________________________。
订正________________________________________。
(4)书写有机化学方程式时,有机物一般要写成结构简式或结构式,并注明反应条件,反应前后原子要守恒。请订正下面方程式的错误。
① 订正_________。
订正_________。
②![]()
![]() 订正___。
订正___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等八种物质存在如下转化关系(反应条件、部分产物未标出).已知:A为正盐,B是能使品红溶液褪色的气体,E是碱性气体,G是红棕色气体.按要求回答问题: 
(1)写出下列物质的化学式:
B , D , E , F .
(2)设计实验检验A溶液中的阳离子,写出实验操作、现象和结论. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,可行的是
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgSO4,含有少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)为加快酸溶速率,可采取的办法有______,写出酸溶时废渣中主要成分发生反应的化学方程式为_________________。
(2)加入H2O2氧化时发生发应的离子方程式为_________________。
(3)用萃取分液的方法除去溶液中的Fe3+。
①检验溶液中是否含有Fe3+的最佳试剂是_________________。
②为使Fe3+ 尽可能多地从水相转移至有机相,采取的操作:向水溶液中加入一定量的萃取剂,_______、静置、分液,并重复多次。
③萃取时,向混合溶液(含Fe2+、Al3+、Mg2+)中加入适量盐酸,使Fe2+ 与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-。该缔合物中,Cl-和Et2O分别取代了Fe2+和H+的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,就从水相转移到有机相中。该萃取剂不能萃取Al3+、Mg2+的原因是_________。
(4)已知:Ksp[Al(OH)3]=1.0×10-33,Ksp[(Mg(OH)2)=1.0×10-12.pH=8.5时Mg(OH)2开始沉淀。室温下,除去MgSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需加入氨水调节溶液pH的范围为____________。
(5)向滤液中加入Na2CO3溶液生成MgCO3 沉淀并用蒸馏水洗涤,检验沉淀是否洗净的操作是________________。
(6)干燥时需低温干燥,温度较高时发生副反应,写出MgCO3·3H2O在323K温度时发生转化的化学方程式________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是一种新能源,利用2CO+O2=2CO2设计燃料电池时,负极发生反应的气体是_______,酸性条件下正极发生反应的电极反应是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是()
A. 甲烷与乙烯共lmol,完全燃烧后生成2molH2O
B. 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种
C. 乙烯可以用作生产食品包装材料的原料
D. 乙酸分子中含有碳氧双键,所以它能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( ) 
A.电流从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13 g Zn溶解时,外电路中就有0.4 mol电子通过
D.铜电极作正极,发生的电极反应为2H++2e﹣═H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com