
【题目】下列实验方案设计中,可行的是
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列关于试剂保存,除杂试剂选择的叙述不正确的是
A. 金属钠应该保存在煤油中 B. 漂白粉可以敞开存放
C. 除去NO中混有的NO2:排水集气 D. 除去Cl2中混有的HCl气体:饱和食盐水洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对物质进行分类是中学生必须要学会的方法。下列各物质在分类上正确的是
A. 白磷、白糖、白糕属于单质 B. 纯碱、烧碱、泡花碱属于碱
C. 盐酸、硝酸、磷酸属于强酸 D. KCl、FeSO4、NaHSO4属于盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含H+、SO42﹣、NO3﹣三种离子,其中H+、SO42﹣的物质的量浓度分别为7.0molL﹣1和2.0molL﹣1 . 取该溶液20mL,加入3.2g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )
A.0.75 L
B.0.336 L
C.1.5 L
D.0.448 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
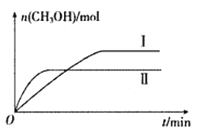
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应![]() 、电环化反应(electrocyclicreaction):
、电环化反应(electrocyclicreaction): ![]() 等。
等。
已知:  ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。
现有一种内酯I(含两个五元环)的合成路线如下(A~I均表示一种有机化合物):

回答下列问题:
(1)化合物A中含有的官能团名称是_______,D的分子式为_______。
(2)由C生成D的反应类型为_______,A形成高聚物的结构简式为_______。
(3)写出F与足量银氨溶液反应的化学方程式_______ 。
(4)化合物H的系统命名为_______ 。
(5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为_______ 。
(6)在化合物I的同分异构体中能同时符合下列条件的是_______ (填写结构简式)。
①具有酚结构;②仅有一种官能团;③具有4种氢原子
(7)2,5-二甲基四氢呋喃(![]() )是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
)是新的液态代用燃料,其具有比能量高、沸点高、可再生等优点。该有机物可由A先与H2发生加成反应等一系列步骤来制备,请写出合成路线______(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于前四周期的8种元素A、B、C、D、E、F、G、H的原子序数依次增大,其中A是所有原子中原子半径最小的,且与B同族,C的基态原子2P能级上只有1个电子,F可与A可按原子个数比1∶1和1∶2形成化合物;F与G同族,H的原子序数为29,根据上述信息描述,请回答下列问题:
(1)请写出上述8种元素中电负性最大的元素与B元素形成常见的化合物的化学式_______(用具体元素符号表示的化学式),写出基态原子的第一电离能最大的元素在周期表中的位置为________。
(2)写出H的原子在基态时的核外电子排布式为____________。
(3)1mol D2A6分子(链状)中含有![]() 键的数目为____________。
键的数目为____________。
(4)已知A2F2分子结构如图a所示,则其中心原子杂化轨道类型为_________。

(5)判断A2F2________(填难或易)溶于DG2,并简要说明原因___________。
(6)C与E形成某化合物的晶胞如图 b所示,则处于晶胞顶角上的原子的配位数为________,若该化合物的密度为![]() g·cm
g·cm![]() ,阿伏加德罗常数为NA,则两个最近E原子间的距离为_______ pm(用含
,阿伏加德罗常数为NA,则两个最近E原子间的距离为_______ pm(用含![]() 、NA的代数式表示)。
、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
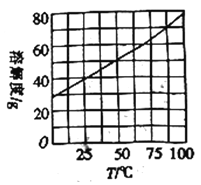
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com