
【题目】关于如图所示的原电池,下列说法正确的是( ) 
A.电流从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13 g Zn溶解时,外电路中就有0.4 mol电子通过
D.铜电极作正极,发生的电极反应为2H++2e﹣═H2↑
【答案】C
【解析】解:A.该原电池中较活泼的金属锌作负极,较不活泼的金属铜作正极,电流从Cu电极通过检流计流向Zn电极,故A错误; B.锌电极上失电子发生氧化反应,Cu电极上得电子发生还原反应,故B错误.
C.铜、锌原电池工作时,若有13g锌被溶解,电路中通过的电子= ![]() ×2=0.4mol,故C正确.
×2=0.4mol,故C正确.
D.原电池放电时,铜作正极,铜离子得电子发生还原反应在铜极上析出,电极反应式为Cu2++2e﹣=Cu,故D错误.
故选C.
A.电流从正极流向负极;
B.失电子发生氧化反应,得电子发生还原反应;
C.根据锌和转移电子之间的关系式计算;
D.原电池放电时,铜作正极,铜离子得电子发生还原反应在铜极上析出.


科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
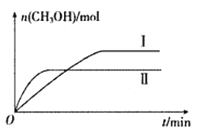
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( ) 
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn
C.若两电极都是金属,则它们的活动性为 X>Y
D.X 极上发生的是还原反应,Y 极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中NO3-的物质的量浓度最大的是
A.500 mL 1 mol/L的KNO3溶液B.500 mL1 mol/L的Ba(NO3)2溶液
C.1000 mL 0.5 mol/L的Mg(NO3)2溶液D.1 L 0.5 mol/L的Fe(NO3)3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
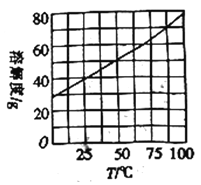
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中对利用K2CO3 去油污有如下叙述:“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱烷衣。”文中涉及的化学反应属于( )
A. 水解反应 B. 置换反应 C. 醋化反应 D. 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下三个热化学方程式: H2(g)+ ![]() O2(g)═H2O(g)△H=a kJmol﹣1
O2(g)═H2O(g)△H=a kJmol﹣1
H2(g)+ ![]() O2(g)═H2O(l)△H=b kJmol﹣1
O2(g)═H2O(l)△H=b kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=c kJmol﹣1
关于它们的下列表述正确的是( )
A.它们都是吸热反应
B.a、b和c均为正值
C.a=b
D.2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 新制饱和氯水中:Al3+、Cu2+、S![]() 、Br-
、Br-
B. 使甲基橙变红的溶液:Mg2+、Fe3+、N![]() 、SCN-
、SCN-
C.  =1×10-13 mol·L-1的溶液中:Na+、K+、Cl-、Al
=1×10-13 mol·L-1的溶液中:Na+、K+、Cl-、Al![]()
D. 由水电离的c(H+)=1×10-13 mol·L-1的溶液中:Ca2+、Ba2+、Cl-、HC![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 铁粉与氯气反应只能生成FeCl3
B. Cl2具有很强的氧化性,在化学反应中只能作氧化剂
C. 11.2LCl2的质量为35.5g
D. 保存氢氟酸时, 常用带橡胶塞的玻璃瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com