
【题目】某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪个氧化性更强? 猜想:①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致.
(2)设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的. 供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到得现象.
选用试剂(填序号) | 实验现象 | |
方案1 | ||
方案2 |
(3)结论 氧化性:Br2>Fe3+ . 故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 .
(4)实验后的思考 ①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 .
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有 ![]() 的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
【答案】
(1)Br2;Fe3+
(2)b;下层(CCl4层)无色;d;溶液变为血红色
(3)2Fe2++Br2=2Fe3++2Br﹣
(4)Fe2+;1mol/L
【解析】解:(1)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.根据题意在足量的氯化亚铁溶液中加入1﹣2滴溴水,若Fe3+氧化性强于Br2 , 则不发生氧化还原反应,溶液呈黄色是由加入溴水引起的;如果Br2氧化性强于Fe3+ , 则发生反应:2Fe2++Br2═2Fe3++2Br﹣ , 生成了Fe3+ , 则溶液呈黄色是由Fe3+引起的.因此①中甲同学认为氧化性:Fe3+>Br2 , 不发生反应,溶液呈黄色是由溴水引起的;②中乙同学认为氧化性:Fe3+<Br2 , 发生反应生成Fe3+ , 溶液呈黄色是由Fe3+引起的,所以答案是:Br2;Fe3+;(2)乙同学的观点认为氧化性:Fe3+<Br2 , 则会发生反应:2Fe2++Br2═2Fe3++2Br﹣ , 由于溴水少量,要全部参与反应,生成物中生成了Fe3+ . 要证明乙同学的观点确实正确,设计两种方案进行实验.方案一:证明溶液中不存在Br2 , 根据题意,选择试剂四氯化碳来进行萃取实验,由于四氯化碳呈无色、密度大于水、与水不互溶、易溶解Br2 , 观察到现象为:出现分层现象,下层为四氯化碳,且呈无色.则证明方案一正确;方案二:证明溶液中存在Fe3+ . 根据题意,选择试剂硫氰化钾溶液,观察到现象为溶液呈血红色,则证明方案二正确,方案一、方案二都正确,即可证明乙同学的观点确实正确,所以答案是:
选用试剂(填序号) | 实验现象 | |
方案1 | b | 下层(CCl4层)无色 |
方案2 | d | 溶液变为血红色 |
·(3)根据结论:氧化性:Fe3+<Br2 , 在足量的稀氯化亚铁溶液中,加入1~2滴溴水时,Br2可以把Fe2+氧化成Fe3+ , Br2本身被还原成Br﹣ . 确定出反应物和生成物后Fe2++Br2﹣Fe3++Br﹣ , 再根据化合价升降法配平,+2价Fe上升到+3价Fe,化合价上升1价,Br2中0价降低到﹣1价,一共降低2价,所以Fe2+前计量数为2,Br2前计量数为1,根据原子守恒,Fe3+前计量数为2,Br﹣前计量数为2,故离子方程式为2Fe2++Br2═2Fe3++2Br﹣ , 所以答案是:2Fe2++Br2═2Fe3++2Br﹣;(4)①FeBr2在溶液中电离出Fe2+、Br﹣ , Cl2通入FeBr2溶液中,既能氧化Fe2+ , 又能氧化Br﹣ , 发生的反应为2Fe2++Cl2═2Fe3++2Cl﹣、2Br﹣+Cl2═Br2+2Cl﹣ . 根据反应2Fe2++Br2═2Fe3++2Br﹣ , 还原剂是Fe2+ , 还原产物是Br﹣ , 还原剂的还原性强于还原产物的还原性,即得还原性:Fe2+>Br﹣ , 因此Cl2先氧化Fe2+ , 后氧化Br﹣ , 所以答案是:Fe2+;
②2.24LCl2(标准状况)的物质的量是0.1mol,得到0.2mol.设溴化亚铁的物质的量是xmol,氯气首先氧化亚铁离子,然后氧化溴离子,则根据电子得失守恒可知0.2=x×1+2x× ![]() ×1,解得:x=0.1,因此溴化亚铁的浓度是0.1mol÷0.1L=1mol/L,所以答案是:1mol/L.
×1,解得:x=0.1,因此溴化亚铁的浓度是0.1mol÷0.1L=1mol/L,所以答案是:1mol/L.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型中完全符合要求的是( )
A. 分解反应 B. 取代反应 C. 复分解反应 D. 化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38.Y元素原子最外层电子数占核外总电子数的 ![]() ;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
(1)写出元素符号:X , Y , Z , W .
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是 .
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是 , 反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 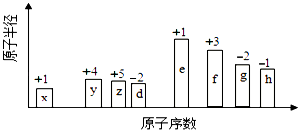
根据判断出的元素回答问题:
(1)f 在元素周期表的位置是;g的离子结构示意图为 .
(2)在z、d、e、f 四种元素中,其离子半径按由大到小的排列顺序为(用 化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性较强的是: .
(3)由x和z元素组成一种四原子共价化合物,写出其电子式 .
(4)由x、z、h三种元素构成的盐,其水溶液显酸性,用离子方程式解释其原因 .
(5)已知1mol e 的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所列出的相应结论正确的是( )
实验事实 | 结论 | |
① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
② | 浓硫酸可除去烧瓶内残留的MnO2 , 稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3﹣>Al(OH)3 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO |
⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH |
A.②③⑤
B.①②③
C.③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】字母A﹣F代表六种不同物质,它们之间可发生如图的转化(部分反应中生成物没有全部列出).其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧.分析图示回答下列问题: 
(1)A可以是或;
(2)E在CO2中燃烧的化学方程式为;
(3)D与F反应的化学方程式为 , 该反应中D表现了性;
(4)50mL 14molL﹣1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为mol,参加反应的铜的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgSO4,含有少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)为加快酸溶速率,可采取的办法有______,写出酸溶时废渣中主要成分发生反应的化学方程式为_________________。
(2)加入H2O2氧化时发生发应的离子方程式为_________________。
(3)用萃取分液的方法除去溶液中的Fe3+。
①检验溶液中是否含有Fe3+的最佳试剂是_________________。
②为使Fe3+ 尽可能多地从水相转移至有机相,采取的操作:向水溶液中加入一定量的萃取剂,_______、静置、分液,并重复多次。
③萃取时,向混合溶液(含Fe2+、Al3+、Mg2+)中加入适量盐酸,使Fe2+ 与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-。该缔合物中,Cl-和Et2O分别取代了Fe2+和H+的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,就从水相转移到有机相中。该萃取剂不能萃取Al3+、Mg2+的原因是_________。
(4)已知:Ksp[Al(OH)3]=1.0×10-33,Ksp[(Mg(OH)2)=1.0×10-12.pH=8.5时Mg(OH)2开始沉淀。室温下,除去MgSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需加入氨水调节溶液pH的范围为____________。
(5)向滤液中加入Na2CO3溶液生成MgCO3 沉淀并用蒸馏水洗涤,检验沉淀是否洗净的操作是________________。
(6)干燥时需低温干燥,温度较高时发生副反应,写出MgCO3·3H2O在323K温度时发生转化的化学方程式________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积和物质的量浓度都相等的盐酸和氢氧化钠溶液中投入足量的铝粉,放出的氢气在同温同压下的体积之比为
A. 1︰1 B. 1︰3 C. 3︰1 D. 1︰2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com