
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38.Y元素原子最外层电子数占核外总电子数的 ![]() ;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
(1)写出元素符号:X , Y , Z , W .
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是 .
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是 , 反应的化学方程式是 .
【答案】
(1)H;O;Mg;Cl
(2)Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O
(3)有气泡、变红;Mg+2H2O ![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
【解析】解:(1)Y元素原子最外层电子数占核外总电子数的3/4,判断出Y为O元素.设X、Y、Z、W的核电核数分别为x、y、z、w,则x+y+z+w=38,x<y,y=8,z>y,w=z+5<18,w≠16 即x<8,x+2z=25,8<z<13,z≠11.①假设x=1则z=12(合理);②假设x=2,则z=23/2(舍去);③假设x=3,则z=11(舍去);④假设x=4,则z=21/2(舍去); ⑤假设x=5,则z=10(舍去);⑥假设x=6,则z=19/2(舍去);⑦假设x=7,则z=9(舍去).故X为H元素,Z为Mg元素,W为Cl元素,所以答案是:H; O; Mg; Cl;(2)Mg、Cl两元素最高价氧化物对应水化物分别是氢氧化镁和高氯酸,反应生成高氯酸镁和水,反应方程式为Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O,所以答案是:Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O;(3)Mg和沸水反应置换出H2且生成碱Mg(OH)2 , 故反应的现象为有气泡、溶液变红.反应的方程式为Mg+2H2O ![]() Mg(OH)2+H2↑, 所以答案是:有气泡、变红;Mg+2H2O
Mg(OH)2+H2↑, 所以答案是:有气泡、变红;Mg+2H2O ![]() Mg(OH)2+H2↑.
Mg(OH)2+H2↑.


科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量分别是n(H)=______mol;n(C)=_______mol
(2)该有机物的分子式_____________,写出所有可能结构简式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
A.950 mL 111.2 g
B.500 mL 117 g
C.1 000 mL 117 g
D.任意规格 111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,集气瓶内充满某混合气体(括号内为体积比),若将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,则集气瓶中的混合气体可能是( ) ①CO、O2(2:1)②NH3、O2(8:1)③NO2、O2(4:1)④N2、H2(1:3)
A.①②
B.②③
C.②④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+ 11O2= 4B2O3+ 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
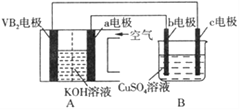
A. VB2电极发生的电极反应为:2VB2+ 11H2O - 22e-= V2O5+ 2B2O3+ 22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,c电极表面先有红色物质析出,b电极有气泡产生
D. 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪个氧化性更强? 猜想:①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致.
(2)设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的. 供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到得现象.
选用试剂(填序号) | 实验现象 | |
方案1 | ||
方案2 |
(3)结论 氧化性:Br2>Fe3+ . 故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 .
(4)实验后的思考 ①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 .
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有 ![]() 的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
关于已知元素C、N、S和未知的元素X、Y、Z,回答下列问题:
(1)Z元素在周期表中的位置为______________。
(2)表中元素原子半径最大的是______________ (写元素符号)。
(3)①S与Z可形成化合物S2Z2,写出它的电子式______________。
②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,写出它的结构式______________。
(4)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体A、B均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________,生成硫酸铜物质的量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com