
【题目】硅元素在周期表中的位置是
A. 第二周期ⅣA族 B. 第三周期ⅣA族
C. 第三周期ⅥA族 D. 第二周期ⅥA族
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是
A. 6.0gSiO2中含有0.1NA个SiO2分子
B. 标准状况下,向1L密闭容器中充入46gNO2气体,容器中的分子数为NA
C. 过氧化钠与水反应,每生成0.1mol氧气,转移电子的数目为0.4NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合物中含有氢原子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是
A. 25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,  减小
减小
D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有着广泛的应用。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体,同时得到浅绿色酸性溶液。为此,他们设计了如下装置验证所产生的气体(夹持装置省略)并进行有关实验。

(1)①若装置A中的试管不加热,则没有明显现象,原因是____________。
②证明有SO2 生成的现象是_____;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4,请写出装置B处反应的化学方程式________________。
(2)取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:
①第一支试管中加入1mLCCl4,充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有____(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为_______。
(3)向盛有H202溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为_________________;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是________________;生成沉淀的原因是_______________ (用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38.Y元素原子最外层电子数占核外总电子数的 ![]() ;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
(1)写出元素符号:X , Y , Z , W .
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是 .
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是 , 反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中正确的是
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.原电池工作时,实现了将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所列出的相应结论正确的是( )
实验事实 | 结论 | |
① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
② | 浓硫酸可除去烧瓶内残留的MnO2 , 稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3﹣>Al(OH)3 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO |
⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH |
A.②③⑤
B.①②③
C.③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是:
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100 mL 2 molL﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. 反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验:
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:___________________与盐酸反应最剧烈。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为__________________________________________
(3)资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。
NaH是离子化合物,能与水反应生成H2;NaAlH4是一种良好的储氢材料,与水反应也能产生氢气,其化学反应方程式为____________________________
Ⅱ.为验证氯、溴、碘三种元素的非金属性强弱,用下图所示装置进行试验(夹持仪器已略去,气密性已检验)
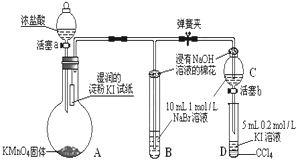
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液由黄色变为棕红色时,关闭活塞a。
④……
(4)A中发生反应生成氯气,请写出该反应的离子方程式:________________________
(5)B、C管口“浸有NaOH溶液的棉花”的作用是__________________________________________
(6)为验证溴的氧化性强于碘,过程④的操作和现象是___________________________
(7)过程③实验的目的是_________________________________________________
(8)请运用原子结构理论解释氯、溴、碘非金属性逐渐减弱的原因:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com